In diesen wilden Zeiten sind korrekte Informationen lebenswichtig um Verunsicherung zu zerstreuen und korrekte Behandlungen einzuleiten. Exzellent und ausführlich verfasst ist der Artikel zu Covid-19 des Internet Book of Critical Care (IBCC) von emcrit. Hier präsentieren wir euch nun die deutsche Version! Herzlichen Dank an Steffen Grautoff, der diesen Artikel nach Rücksprache mit dem Originalautor Josh Farkas übersetzt hat (Aktualisierung der Übersetzung durch Martin). Ebenso wollen wir uns bei den Pin-Up-Docs für ihre tolle Arbeit in diesem Bereich bedanken – ein erstes gemeinsames Video zu Grundlagen bei COVID-19 gibt’s hier.
ACHTUNG!
Der Text wurde von uns mehrfach überarbeitet, das ist uns aufgrund der aktuellen beruflichen Belastungen nicht mehr durchgehend möglich. Der aktueller Stand ist 31.03.2020, es sind also einige Aspekte nicht up to date (insbesondere differenzierte Beatmung etc.). Für aktuelle deutschsprachige Ressourcen verweisen wir auf unsere Videos zum Thema sowie das Projekt „Mediziner für Mediziner gegen Covid-19„, sonst empfehlen wir natürlich den häufig aktualisierten Original-Artikel auf englisch.
Trotz sorgfältiger Prüfung sind Fehler durch Übersetzung und/oder durch Aktualisierungen bei dynamischer Lage möglich, daher gilt: Bitte selber prüfen, keine Gewähr!
Biologie – Grundlagen
Basics
- COVID-19 ist ein nicht-segmentierter, RNA virus mit positiver Polarität.
- COVID-19 ist Teil einer Familie von Coronaviren. Diese beinhalten:
- (i) Vier Coronaviren, die weit verbreitet sind und normalerweise Erkältungskrankheiten verursachen (kann bei komorbiden Patienten eine virale Pneumonie auslösen)
- (ii) SARS und MERS – diese haben Epidemien mit hoher Mortalität ähnlich zu COVID-19 ausgelöst. COVID-19 ist SARS am ähnlichsten.
- Es bindet über das Angiotensin-Converting Enzym 2 (ACE 2) Rezeptor, der auf Typ 2 Alveolarzellen und intestinalen Epithelien vorhanden ist. (Hamming 2004).
- Dieses ist der selbe Rezeptor, der von SARS genutzt wird (daher der Name des Virus “SARS-CoV-2” bei COVID-19).
- Wenn man über mögliche Therapien nachdenkt, sollte einem bewusst sein, dass SARS (d.h. “SARS-CoV-1”) das Virus ist, welches die engste Beziehung zu COVID-19 hat.
- COVID-19 mutiert, was zu einer Verkomplizierung führt (siehe Bild unten). Die Virulenz und Übertragung wird sich daher ändern und man kann sie nicht vorhersagen. Es gibt Hinweise, dass es grob gesagt zwei Gruppen von COVID-19 gibt.
Das erklärt warum die ersten Berichte aus Wuhan eine höhere Mortalität beschreiben als die neueren Fallserien. (Tang et al. 2020; Xu et al 2020).(Phylogenetische Karten von weiteren Ablegern können hier eingesehen werden)
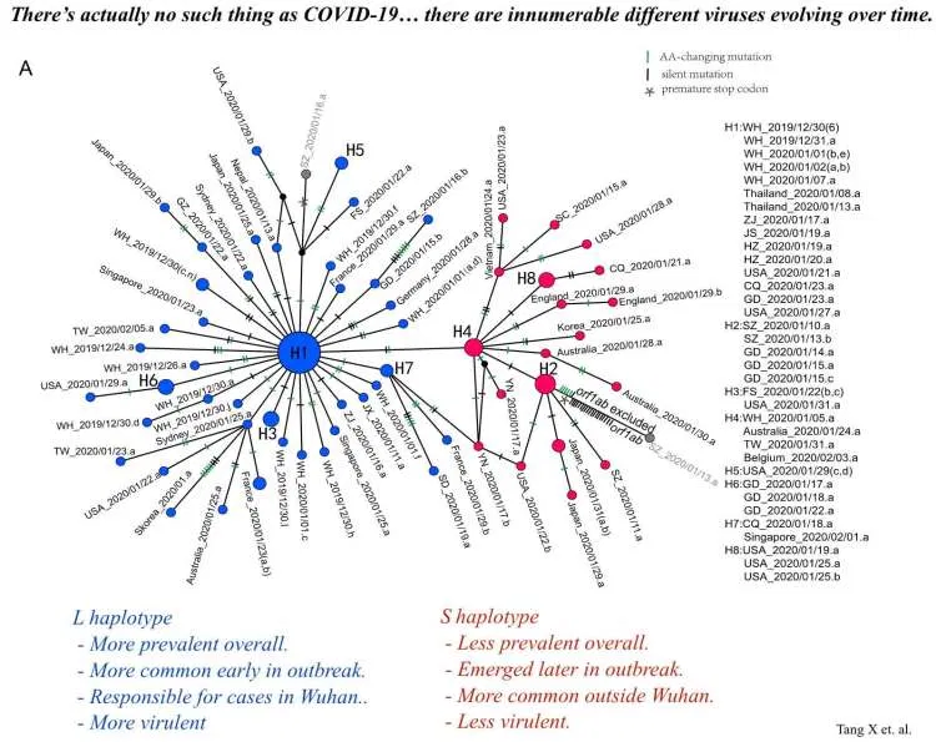
Nomenklatur, die in diesem Kapitel verwendet wird
- Korrekterweise sollte das Virus “SARS-CoV-2” benannt werden und die klinische Erkrankung heißt “COVID-19.” Das ist verwirrend, daher wird in diesem Kapitel “COVID-19” für beide Entitäten verwendet.
- Der Begriff “SARS” wird für das ursprüngliche SARS-Virus aus dem Jahr 2003 verwendet (welches mittlerweile in SARS-CoV-1 umbenannt wurde).
Pathophysiologie
- (1) ARDS
- Die Primär-Pathologie ist das ARDS, charakterisiert durch diffusen alveolaren Schaden (z.B. inkl. hyaline Membrane) Pneumozyten mit viralem zytopathischem Effekt können detektiert werden und sind ein Hinweis auf direkten Virus-Schaden (statt einer ausschließlichen hyper-inflammatorischen Verletzung; Xu et al 2/17).
- (2) Zytokin-Sturm
- Wachsende Evidenz zeigt, dass manche Patienten auf COVID-19 mit einem überbordenden Zytokin-Sturm reagieren (mit Eigenschaften einer bakteriellen Sepsis oder Hämophagocytische Lymphohistiocytosis).
- Klinische Marker können CRP- und Ferritin-Erhöhungen sein, die vermutlich mit der Schwere der Erkrankung und Mortalität korrelieren. (Ruan 3/3/20).
Krankheitsphasen ??
- Es scheinen verschiedenen Krankheitsphasen vorzukommen, durch die betroffene Patienten gehen.
- (Nr. 1) Replikatives Stadium – Virale Replikation kommt über mehrere Tage vor. Eine immanente Immunantwort geschieht, aber durch diese Antwort wird das Virus nicht kontrolliert. Eher milde Symptome können durch direkte virale cytopahische Effekte und immanente Immunantwort entstehen.
- (Nr. 2) Adaptiertes Immunitäts-Stadium – Eine adaptierte Immunantwort tritt dann auf. Dieses führt zu einem fallenden Virus-Titer. Aber es kann auch den Level der Entzündungs-Zytokine erhöhen und zu Gewebsschaden führen – dieses führt zu klinischer Verschlechterung. Es gibt die Vorstellung, dass dieses zu einer durch den Virus-bedingen Hämophagozytischen Lymphohistiozytosis (HLH) führen kann (Mehta et al.). Weitere Diskussion über diese Entität und mögliche Therapie hier.
- Dieser Verlauf kann das klinische Phänomen erklären, dass Patienten für einige Tage eher wenig beeinträchtigt sind, aber sich dann plötzlich verschlechtern wenn sie in das adaptierte Immunitäts-Stadium kommen (z.B. Young et al. 3/3/2020).
- Dieses hat potentiell wichtige klinische Folgen:
- Initiale klinische Symptomatik lässt keine Rückschlüsse auf mögliche Verschlechterung im Verlauf zu. Kluge Strategien werden zur Risiko-Stratifizierung benötigt (siehe den Abschnitt weiter unten Prognose).
- Anti-virale Therapien müssen früh angewandt werden, um den besten Effekt zu erzielen (während der replikativen Phase).
Immunsuppressive Therapien (z.B. low-dose Steroide) können am besten im adaptiven Immunitätsstadium begonnen werden (mit dem Ziel die immunopathologische Antwort bei dem sehr kranken Patientenkollektiv etwas zu dämpfen). Aber dies bleibt spekulativ!!
Übertragung
Übertragungsweg Tröpfcheninfektion
- COVID-19 Übertragung kann über eine Tröpfcheninfektion geschehen (mit einem Risiko bis zu 6 feet = 1,83 m Entfernung vom Patienten) (Carlos del Rio 2/28).
- Dieses ist typisch für Atemwegsinfekte wie Influenza.
- Übertragung via Tröpfcheninfektion kann durch eine Standard OP-Nasen-Mund-Maske verhindert werden.
Übertragung durch die Luft ??
- Es ist unklar, ob COVID-19 durch die Luft (kleine Partikel die in der Luft über einen längeren Zeitraum verbleiben können) übertragen wird. Übertragung durch die Luft würde bedeuten, dass FFP2-Masken statt OP-Nasen-Mund-Masken zum Schutz notwendig wären. Die Kontroverse hierzu wird dort diskutiert: Shiu et al 2019. Eine kürzlich erschienene Studie zeigte, dass das Virus in Aerosolen mehrere Stunden überleben kann, so dass auch eine Aerosol-Übertragung plausibel erscheint (Doremalen et al. 3/17/19).
- Entsprechende Vorkehrungen, um Übertragungen durch die Luft zu vermeiden, waren bei MERS und SARS als Vorsichtsmaßnahme begonnen worden (es gab keine klare Evidenz, dass Coronaviren durch die Luft übertragbar sind). Diese Praxis wurde auf COVID19 übertragen.
- Leitlinien sind uneinig ob Vorkehrungen für Übertragungen durch die Luft getroffen werden sollen:
- Die Kanadischen Leitlinien und die Leitlinien der WHO haben beide nur Vorkehrungen zur Übertragung als Tröpfcheninfektion für den normalen Umgang mit COVID-19 empfohlen. Dennoch haben beide Leitlinien empfohlen, bei Prozeduren, bei denen Aerosole entstehen können (z.B. Intubation, nicht-invaisve Beatmung, CPR, Maskenbeatmung und Bronchoskopie) Vorkehrungen für eine potentielle Übertragung durch die Luft zu treffen.
- ANZICS empfiehlt, dass bei kritisch kranken Patienten mit COVID-19 Vorkehrungen für eine potentielle Übertragung durch die Luft zu treffen sind.
- Die amerikanische CDC hatte empfohlen grundsätzlich bei Umgang mit COVID19-Patienten Vorkehrungen für eine Übertragung durch die Luft zu treffen. Allerdings hat die CDC kürzlich ihre Position hierzu geändert, so dass bei fehlenden FFP2-Masken auch Mund-Nasen-Masken als Schutz akzeptabel sind.
- Wenn man für sämtliche gesicherte oder mögliche COVID-19-Patienten Vorkehrungen zur Übertragung durch die Luft trifft, wird man schnell viele FFP2-Masken verbrauchen. Das kann dazu führen, dass Mitarbeitende letztendlich ungeschützt sein müssen, obwohl sie Prozeduren durchführen, bei denen ein hohes Risiko zur Aerosol-Entwicklung besteht.
- Im Kontext einer Pandemie sind die Kanadischen und WHO-Leitlinien bei limitierten Ressourcen vernünftiger (d.h. in den meisten Gebieten). Dennoch gilt, dass Infektionskontrolle letztendlich eine lokale Angelegenheit ist. Daher sollte man den Anordnungen des Krankenhauses folgen.
- Unterdruck-Behandlungsräume sind für die Behandlung initial und im Intensiv-Setting ideal, werden aber rasch nicht mehr verfügbar sein. Dann könnten portable HEPA-Filter hilfreich sein (SSC-Leitlinie Seite 7)
Übertragung über Kontakt (“Erreger-zu-Gesicht”)
- Diese Art der Übertragung wird häufig zu wenig beachtet, ist aber sehr wichtig. Sie funktioniert folgendermaßen:
- (i) Jemand mit COVID-19 hustet und bringt somit Tröpfchen in die Umgebung, die das Virus enthalten. Tröpfchen bleiben auf Oberflächen im Raum und erzeugen einen dünnen Coronavirus-Film. Das Virus kann auch in nasalem Ausfluss enthalten sein und kann auf diese Art in die Umwelt gelangen.
- (ii) Das Virus bleibt so in der Umwelt. Menschliche Coronaviren können auf Oberflächen bis zu einer Woche überleben (Kampf et al 2020). Es ist nicht bekannt wie lang COVID-19 in der Umgebung überleben kann, aber es könnte sogar länger sein (manch tierisches Coronavirus kann über Wochen überleben!).
- (iii) Eine andere Person berührt die kontaminierte Fläche Stunden oder Tage später und überträgt das Virus so auf die Hand.
- (iv) Wenn die Hand Schleimhäute berührt (Auge, Nase oder Mund) kann dieses die Infektion übertragen.
- Jeder Versuch, die Verbreitung aufzuhalten muss Anstrengungen unternehmen, die Kontaktübertragung aufzuhalten. Die obige Verlaufskette kann durch verschiedene Maßnahmen unterbrochen werden:
- (a) Normale Reinigung von Umgebungsoberflächen (z.B. durch 70% Ethanol oder 0,5% Natriumhypochlorit Lösung, für Details hierzu siehe Kampf et al 2020 und CDC Leitlinien).
- (b) Hand-Hygiene (Hohe Konzentration des Ethanol neutralisiert das Virus und ist leicht durchzuführen, so dass dieses zu empfehlen ist, wenn die Hände nicht sichtbar verschmutzt sind) (Kampf 2017).
- (c) Nicht das Gesicht anfassen. Dieses ist beinahe unmöglich, da wir unbewusst häufig das Gesicht berühren. Der größte Vorteil am Tragen einer Nasen-Mund-Maske könnte die Tatsache sein, dass es eine Barriere darstellt, Mund oder Nase zu berühren.
- Jedes Teil medizinischen Equipments könnte mit COVID-19 kontaminiert sein und potentiell das Virus an Behandler weitergeben. (z.B. Stethoskop-Ohroliven und Schuhe). Eine aktuelle Studie hat weit verbreitete Ablagerung von COVID-19 in einem Patientenzimmer nachweisen können, glücklicherweise ist dieses durch Natriumdichloroisocyanurat beseitigbar (Ong et al 2020).
- Die ANZICS Leitlinien empfehlen, das Stethoskop so wenig wie möglich zu benutzen. (Kommentar: Pro CT, contra Stethoskop!)
Wann kann die Übertragung geschehen?
- (Nr.1) Asymptomatische Übertragung (bei Menschen mit keinen oder minimalen Symptomen) scheint möglich (Carlos del Rio 2/28).
- (Nr. 2) Übertragung scheint ungefähr acht Tage nach Beginn der Erkrankung zu erfolgen.
- Patienten können weiter eine positive pharyngeale PCR für mehrere Wochen nach Rekonvaleszenz haben (Lan 2/27). Allerdings sind Viruskulturen nicht in der Lage existenzfähige Viren länger als ~8 Tagen nach klinischer Erkrankung zu produzieren (Wolfel 2020). Das bedeutet, dass bei verlängert nachweisbarem positiven PCR-Befund dieses nicht unbedingt mit klinischer Virusübertragung korreliert. Allerdings hatten alle Patienten in Wolfel et al. nur eine milde Form der Erkrankung, daher kann es möglich sein, dass es bei schwerwiegenderen Verläufen auch verlängerte Übertragbarkeit gibt.
- CDC Empfehlugen sind unklar bezüglich der Länge der Isolationsempfehlung bei nachgewiesener COVID-19-Infektion. Es ist empfehlenswert, zwei PCR-Testungen (je eine nasopharyngeal und eine pharyngeal) in zeitlichem Abstand von > 24 Stunden bestimmen zu lassen bevor man Vorsichtsmaßnahmen beendet. (Kommentar: Siehe auch RKI-Empfehlung zur Entlassung von Patienten mit COVID-19!)
R⌀
- R⌀ ist die Durchschnittszahl der Menschen, die von einer infizierten Person angesteckt werden.
- Wenn R⌀ <1, wird die Epidemie auslaufen.
- Wenn R⌀ = 1, wird die Epidemie konstant weiterlaufen.
- Wenn R⌀ >1, wird sich die Epidemie exponentiell ausbreiten.
- Aktuelle Schätzungen liegen bei R⌀ ~2.5-2.9 (Peng PWH et al, 2/28). Dies läge etwas höher als die saisonale Influenza.
- R⌀ wird bestimmt durch das Virus und zusätzlich durch menschliches Verhalten. Interventionen wie “social distancing” (Abstand halten) und verbesserte Hygiene führt zu einer Abnahme von R⌀.
- Die Kontrolle der Verbreitung von COVID-19 in China beweist, dass R⌀ eine beeinflussbare Zahl ist und dass sie durch effektive Interventionen im öffentlichen Gesundheitsbereich reduziert werden können.
R⌀ an Bord des Kreuzfahrtschiffes “Diamond Princess” war 15 – ein Hinweis, dass schlechte Hygiene zur Steigerung von R⌀ führen kann (Rocklov 2/28).
Persönliche Schutzausrüstung

Ausrüstung
- (1) Kontakt-Vorkehrungen (wasserabweisender Kittel und Handschuhe)
- (2) Eine Atemschutz-Maske (wird diskutiert weiter oben im Abschnitt Übertragung)
- FFP2/3 Maske oder Schutzanzüge als “powered, air-purifying respirator” (“PAPR”)
- Mund-Nasen-Maske („OP-Mundschutz“) bei Patienten, die nicht Prozeduren ausgesetzt sind, die Aerosole bilden (basiert auf WHO Leitlinien & Kanadischen Leitlinien)
- Eine Anästhesie-Maske kann in-line mit einem Virus-Filter wie MacGyver zu einer FFP2-Maske umgebaut werden (siehe Video unten). Ein Nachteil kann sein, dass die Maske selber mit COVID-19 verkeimt ist (daher sollte man vorsichtig die Maske zwischen dem jeweiligen Gebrauch komplett reinigen).
- (3) Brille oder Augenschutz
- (4) Haarschutz für Prozeduren, bei denen Aerosole entstehen können (weiter oben im Text aufgeführt).
- (5) Haube / Gesichtsschutz (Face Shield) sollte insbesondere während der Intubation verwendet werden (dieses kann man notfalls aus einem Müllbeutel basteln).
- Schuhe: Schutz um die Schuhe sind nicht empfohlen, da das Entfernen dieser eine erhöhte Exposition bedeuten kann (ANZICS Leitlinien).
- Einfach zu reinigende Schuhe, die man nicht berühren muss, sind zu empfehlen (z.B. OP-Schuhe)
- Anmerkung: Die genaue Art von Ausrüstung is wahrscheinlich weniger wichtig als diese korrekt zu verwenden.
- https://youtu.be/Es_iY5WJdmI
An- und Ausziehen von PSA
- Es ist äußerst wichtig zu verstehen wie man PSA an- und wieder auszieht (besonders wenn Kontaktübertragung der vorherrschende Übertragungsweg ist)
- Ablegen von verschmutzter PSA ist der kritischste und schwierigste Aspekt dabei!
- An- und Ausziehen von PSA sollte bestenfalls geübt werden bevor Patienten aufgenommen werden müssen (z.B. Simulationsübung).
- Das nachfolgende Video beschreibt wie man PSA benutzt (die ersten 5 min. sind verzichtbar):
Einige wertvolle Hinweise zum Thema PSA
- Bei dem Übergang Handschuh zu Kittel ist Vorsicht geboten. Der Kittel sollte in die Handschuhe hineingesteckt sein (so dass keine Lücke zurückbleibt). Der Gebrauch von Handschuhen mit verlängertem Bündchen erleichtert dieses (ähnlich zu sterilen Handschuhen). Handschuhe mit einem langen Bündchen können es erleichtern, Kittel und Handschuhe in einem Vorgang zu entfernen (siehe 12:30 min im Video falls die Erklärung allein sinnlos klingt)
- Wenn man die PSA entfernt, immer Desinfektionsmittel auf Alkohol-Basis für die Handschuhe benutzen.
- Nachdem PSA komplett entfernt wurde, muss erneut Desinfektionsmittel für Hände und Handgelenke verwendet werden.
- Erstelle ein mehrstufiges Protokoll wie PSA entfernt werden soll. Zwei Beispiele sind weiter unten gezeigt, aber dieses kann davon abweichen, je nachdem welche Kleidung vorhanden ist.
- Beim Entkleiden kann es sinnvoll sein, dass jemand einen dabei beobachtet (um auf die Technik zu achten). Falls dieses nicht möglich ist, kann ein Spiegel beim Entkleiden helfen.


Anzeichen und Symptome
- COVID-19 kann unspezifische Symptome, Symptome des oberen und unteren Respirationstraktes und weniger häufig gastrointestinale Symptome verursachen. Die meisten Patienten klagen über unspezifische Symptome und Symptome des unteren Respirationstraktes (z.B. Fieber und Husten).
- Fieber:
- Die Studienlage bzgl. des Auftretens von Fieber ist unterschiedlich (von 43% bis 98% wie in der obigen Tabelle gezeigt). Dieses kann an der exakten Methodik der verschiedenen Studien liegen, verschiedene Stufen der Krankheitsschwere bei verschiedenen Kohorten oder unterschiedlichen Erregerstämmen des Virus an verschiedenen Orten. Zusätzlich haben manche Studien Fieber als Temperatur > 37,3°C definiert (Zhou et al. 3/9/20).
- Unabhängig von den genauen Zahlen – das Fehlen von Fieber reicht nicht, um COVID-19 auszuschließen.
- Gastrointestinale Symptome: bis zu 10% der Patienten zeigen initial gastrointestinale Symptome (z.B. Diarrhoe, Nausea), diese Symptome können vor der Entwicklung von Fieber und Dsypnoe auftreten. (Wang et al. 2/7/20).
- “Stumme Hypoxämie” – manche Patienten können Hypoxämie und respiratorisches Versagen ohne Dyspnoe entwickeln (besonders Ältere)(Xie et al. 2020).
- Die körperliche Untersuchung ist normalerweise unspezifisch. Ungefähr 2% der Patienten können eine Pharyngitis oder Vergrößerungen der Tonsillen zeigen. (Guan et al 2/28).
Es ist wichtig zu wissen, dass manche Patienten nur gastrointestinale Symptome beklagen. Leider sind die meisten diagnostischen Algorithmen nicht in der Lage, solche Patienten zu detektieren und entsprechend zu isolieren.
Typischer Verlauf der Erkrankung
- Inkubationszeit liegt im Mittel bei ~4 Tagen (mittlerer Bereich liegt bei 2-7 Tagen), bis zu 14 Tage möglich (Carlos del Rio 2/28).
- Typischer Verlauf bei schwer Betroffenen (basierend auf einer Analyse von mehreren Studien von Arnold Forest)
- Dyspnoe ~ 6 Tage nach Ansteckung.
- Aufnahme ~8 Tage nach Ansteckung.
- ICU Aufnahem/Intubation ~10 Tage nach Ansteckung. Allerdings können die Zeitspannen variieren (manche Patienten sind stabil für mehrere Tage nach Aufnahme, aber verschlechtern sich dann akut).
Labor
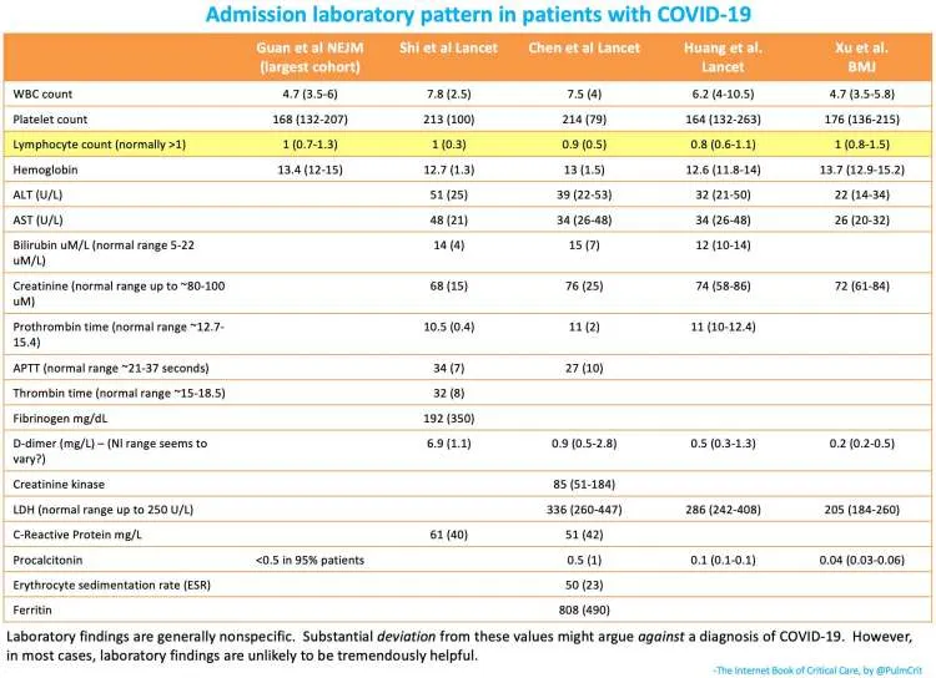
Großes Blutbild
- Das kleine Blutbild ist meist normal.
- Lymphopenie ist häufig, zu diagnostizieren in ~80% der Patienten (Guan et al 2/28, Yang et al 2/21).
- Milde Thrombozytopenie ist häufig (aber Thrombozyten sind selten <100). Niedrige Thrombozyten sind ein schlechter prognostischer Marker (Ruan et al 3/3).
Gerinnung
- Die Gerinnungsergebnisse sind relativ normal bei Aufnahme, obwohl erhöhte D-Dimere häufiger auftreten (obige Tabelle).
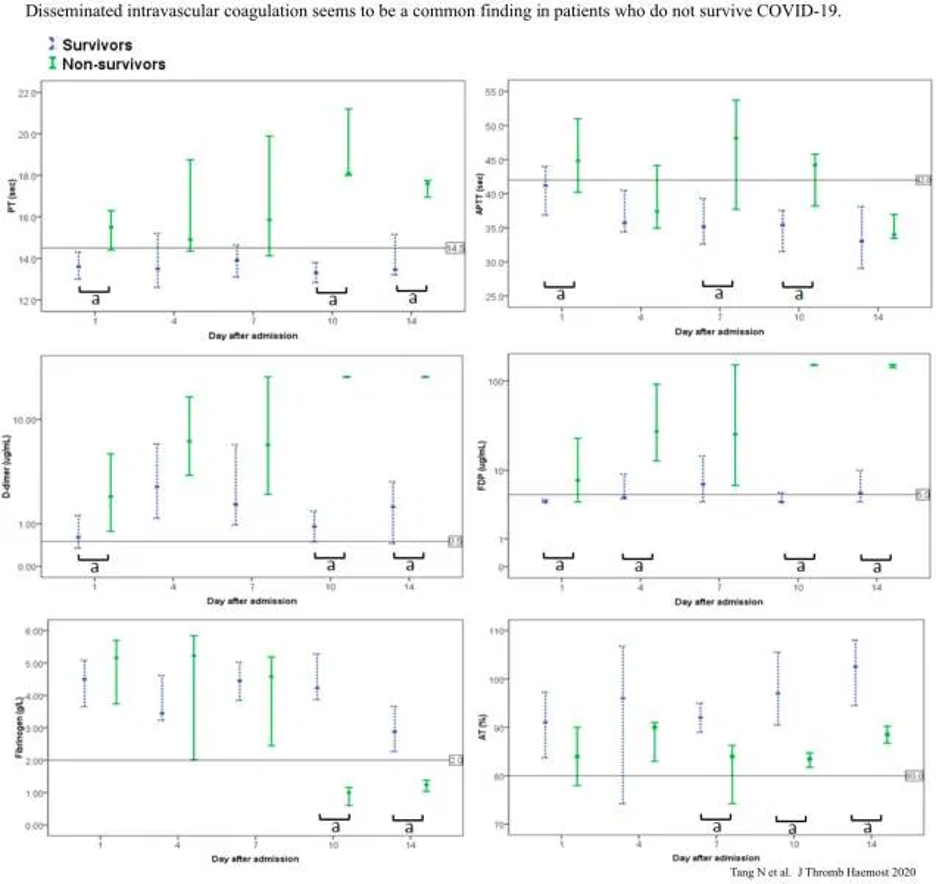
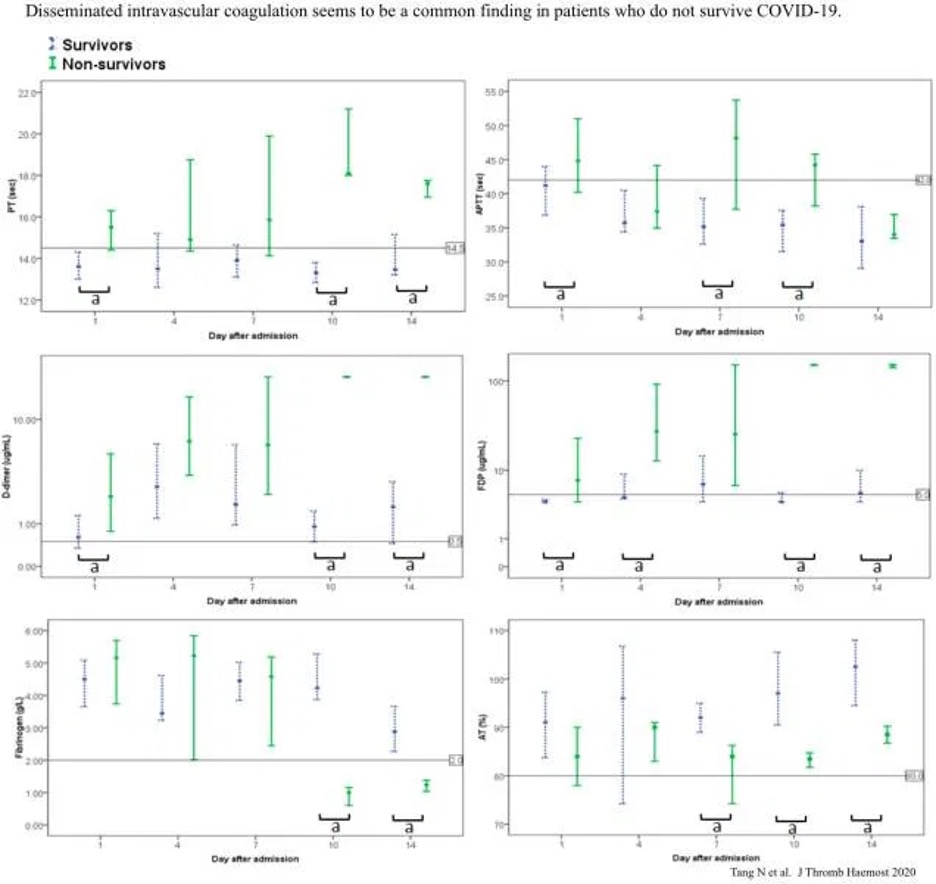
- Disseminierte intravasale Koagulation (DIC) kann im Verlauf entstehen und korreliert mit einer schlechten Prognose (Bild weiter unten) (Tang et al. 2020).
Entzündungswerte
- Procalcitonin
- COVID-19 scheint PCT nicht zu erhöhen. Beispielsweise zeigte die größte Fallserie PCT <0.5 in 95% der Patienten (Guan et al 2/28).
- Erhöhtes PCT kann hinweisgebend auf eine Alternativ-Diagnose sein. (z.B. ausschließlich bakterielle Pneumonie). Für Patienten, die mit COVID-19 aufgenommen wurden, ist ein erhöhtes PCT hinweisgebend für eine bakterielle Superinfektion.
- C-reaktives Protein (CRP)
- COVID-19 erhöht CRP. Dieses korreliert mit Schwere der Erkrankung und Prognose. Bei einem Patienten mit schwerem respiratorischem Versagen und einem normalen CRP sollte an eine nicht-COVID-19-bedingte Erkrankung gedacht werden (z.B. Herzinsuffizienz).
- Young et al. 3/3 haben herausgefunden, dass niedrige CRP-Werte häufig bei Patienten vorkommen, die keinen Sauerstoff benötigen. (mean 11 mg/L, interquartile range 1-20 mg/L) im Vergleich zu Patienten, die hypoxämisch wurden (mean 66 mg/L, interquartile range 48-98 mg/L).
- Ruan et al 3/3 haben CRP-Werte mit Mortalitätsrisiko abgeglichen (überlebende Patienten hatten einen Mittelwert des CRP von ~40 mg/L mit einem Interquartilsabstand von ~10-60 mg/L, wobei Patienten, die starben einen Mittelwert von 125 mg/L mit einem Interquartilsabstand von ~60-160 mg/L hatten) (Bild weiter unten im Abschnitt Prognose).
Evaluation möglicher Differentialdiagnosen
- PCR für Influenza und andere Viren, die Atemwegserkrankungen verursachen (z.B. RSV), kann hilfreich sein. Bei Nachweis anderer Viren, die Atemwegserkrankungen verursachen, kann dennoch eine Co-Infektion mit COVID-19 vorliegen. Allerdings sollte eine andere Erklärung für die Symptome des Patienten den Verdacht auf COVID-19 deutlich senken.
- Normale konventionelle Virustests, die in manchen Kliniken vorhanden sind, können auf “Coronavirus” testen.
- Diese Tests können nicht COVID-19 nachweisen!
- Der PCR Test auf “Coronavirus” ist entwickelt worden, um einen von vier Coronaviren zu detektieren, die normalerweise milde Erkrankungen verursachen.
- Ironischerweise macht ein positiver konventioneller Test eine COVID-19-Infektion weniger wahrscheinlich.
- Blutkulturen sollten wie sonst auch für die üblichen Indikationen abgenommen werden.
Spezifische Tests für COVID-19
Aktuell werden in den USA alle Tests von staatlichen Referenzlabors durchgeführt. Abstrichröhrchen und Tests sollten mit dem Department of Health koordiniert werden.
[Kommentar: In Deutschland gibt es viele lokale Laboratorien, die die Bestimmung durchführen]
Abstrichröhrchen
- (1) Nasopharyngealer Abstrich sollte abgenommen werden.
- (2) Falls intubiert, sollte tracheales Aspirat abgenommen werden.
- (3) Bronchoalveoläre Lavage oder Sputum durch produktiven Husten sind Möglichkeiten bei nicht-intubierten Patienten. Allerdings kann die Gewinnung des Abstrichs ein potentielles Risiko für eine Übertragung bedeuten.
- Es ist zu bezweifeln, ob die Tests vorteilhaft sind wenn sie nur zum Zweck des Nachweises auf Coronavirus dienen. (siehe Abschnitt weiter unten bzgl. Bronchoskopie).
Limitationen bzgl. der Performance der PCR
- Es gibt mehrere wichtige Limitationen, weshalb es schwierig ist, abzuwägen, wie zuverlässig die PCR ist.
- (1) Die Zuverlässigkeit von PCR als nasalem Abstrich hängt davon ab, wie tief die Probe genommen wird. Schlechte Technik kann dazu führen, dass die PCR unzuverlässig ist.
- (2) COVID-19 ist nicht eine binäre Erkrankung, sondern eher ein Spektrum von Erkrankungen. Kränkere Patienten mit einer hohen Viruslast können eher ein positives Ergebnis haben. Genauso kann die Gewinnung zu Beginn der Erkankung eine niedrigere Sensitivität haben als wenn die Probe später genommen wird.
- (3) Den meisten aktuellen Studien fehlt ein “Gold-Standard”, um COVID-19 zu diagnostizieren. Zum Beispiel bei Patienten mit positivem CT-Befund und negativer PCR bleibt es unklar, ob sie COVID-19 haben (ist es ein falsch-positiver CT-Befund oder eine falsch-negative PCR?).
- (Serologien von Genesenden könnte das Problem vielleicht lösen, aber es gibt dazu noch keine Daten.)
Spezifität
- Spezifität scheint höher zu sein (obwohl Kontamination falsch-positive Befunde verursachen kann).
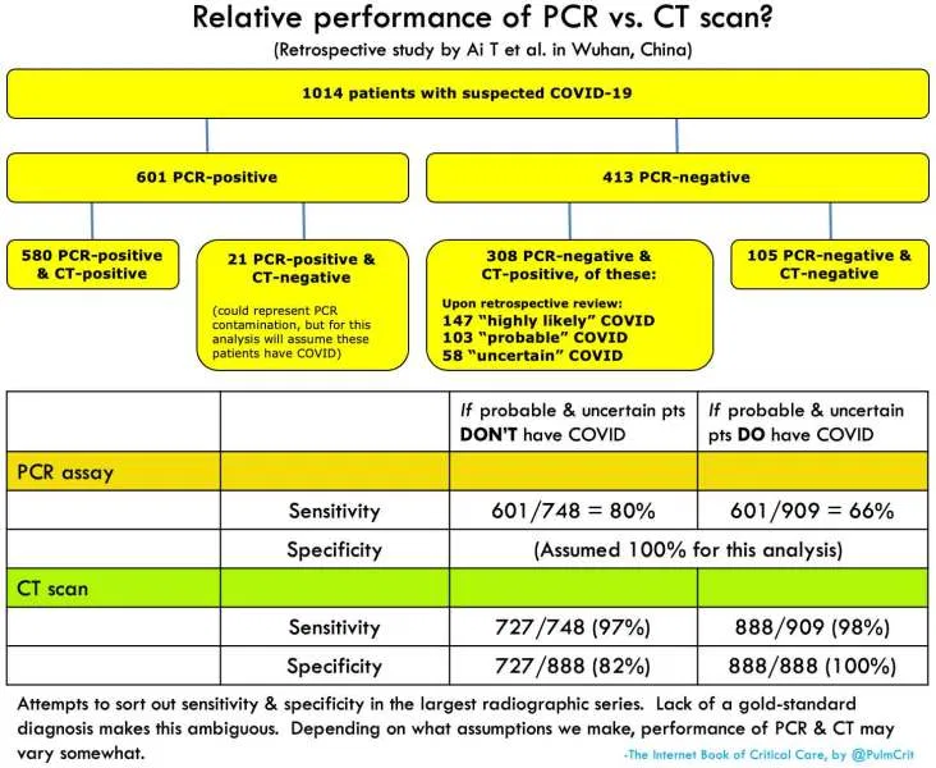
Sensitivität ist möglicherweise nicht besonders gut!
- Sensitivität im Vergleich zum CT:
- In einer Fallserie diagnostiziert auf Basis klinischer Kriterien und CT Befunde war die Sensitivität der RT-PCR nur bei ~70% (Kanne 2/28).
- Sensitivität hängt davon ab, was man bei Patienten annimmt, bei denen widersprüchliche Daten existieren (z.B. zwischen 66-80%; Bild oben) (Ai et al.).
- Bei Patienten mit Verdacht auf COVID-19 und einer negativen initialen PCR war die Folge-PCR positiv in 15/64 Patienten (23%). Daraus lässt sich eine Sensitivität der PCR von <80% folgern. Konversion von negativer zu positiver PCR scheint ein paar Tage zu brauchen. Das CT kann häufig die Erkrankung schon vor einer positiven PCR zeigen (Ai et al.).
- Fazit?
- PCR scheint eine Sensitivität um ~75% zu haben.
- Eine einzige negative RT-PCR kann COVID-19 nicht ausschließen (insbesondere wenn diese von einem nasopharyngealen Abstrich oder in einem frühen Stadium der Erkrankung abgenommen wird).
- Wenn RT-PCR negativ ist, aber der Verdacht auf COVID-19 besteht, sollte die Isolation fortgesetzt werden und eine erneute Probenbestimmung einige Tage später in Erwägung gezogen werden.
Röntgen Thorax und CT
Befunde in Röntgen Thorax und CT
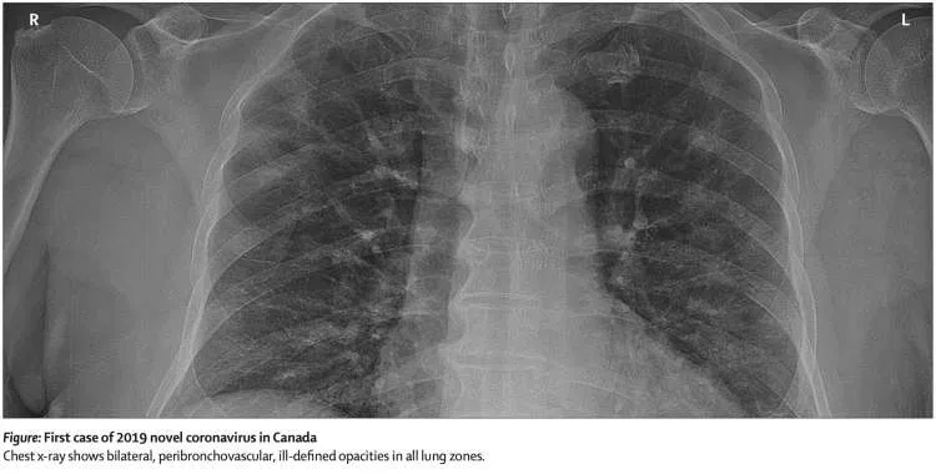
- Der typische Befund zeigt sich als bruchstückhafte Milchglastrübungen (“patchy ground glass opacities”), die vornehmlich peripher und basal erscheinen (Shi et al 2/24). Die Anzahl der betroffenen Lungensegmente steigt mit Schwere der Erkrankung. Je länger die Erkrankung dauert, desto mehr können sich die Eintrübungen in dichte Konsolidierungen verwandeln.
- Infiltrate können im Röntgen-Thorax subtil zu sehen sein (Beispiel oben von Silverstein et al).
- Befunde, die normalerweise nicht gesehen werden und die auf eine alternative oder zusätzliche Diagnose hinweisend sind:
- Pleuraerguss ist selten (nur in ~5%).
- COVID-19 verursacht nicht Massen, Hohlraumbildung oder Lymphadenopathie.
Sensitivität und zeitlicher Verlauf
- Limitationen der Daten
- Daten von verschiedenen Studien sind widersprüchlich. Dieses liegt am ehesten an unterschiedlichen Leveln von Expositionsintensität and Schwere der Erkrankung (Kohorten mit hoher Expositionsintensität und Erkrankungsschwere haben eher radiologische Veränderungen).
- Sensitivität des CT?
- Sensitivität bei Patienten mit positiver RT-PCR ist hoch. Exakte Zahlen sind unterschiedlich, wahrscheinlich reflektieren sie die Variablität wie CTs interpretiert werden (es gibt aktuell keine präzisen Definitionen wann ein CT-Befund als “positiv” gewertet wird).
- Sensitivität von 86% (840/975) in Guan et al.
- Sensitivität von 97% (580/601) in Ai et al.
- Bei Patienten mit ausschließlich unspezifischen Allgemeinsymptomen (aber ohne respiratorische Symptome), ist das CT weniger sensitiv (z.B. vielleicht ~50%) (Kanne 2/27).
- Sensitivität bei Patienten mit positiver RT-PCR ist hoch. Exakte Zahlen sind unterschiedlich, wahrscheinlich reflektieren sie die Variablität wie CTs interpretiert werden (es gibt aktuell keine präzisen Definitionen wann ein CT-Befund als “positiv” gewertet wird).
- Können CT-Abnormalitäten vor Symptomen auftreten?
- Shi et al. hat CTs bei 15 Beschäftigten im Gesundheitswesen durchgeführt, die COVID-19 entwickelten bevor sie symptomatisch wurden.
- Mattscheibenartige Eintrübungen waren in 14/15 Patienten zu sehen! 9/15 Patienten hatten periphere Lungenbeteiligung (einige bilateral, einige einseitig).
- Auftreten von CT-Abnormalitäten vor Auftreten von Symptomen könnte bei asymptomatischen Trägern vorhanden sein. (wie weiter oben diskutiert).
- Röntgen-Thorax
- Sensitivität des Röntgen-Thorax ist niedriger als beim CT für subtile Trübungen. Bei Guan et al. war die Sensitivität bei 59%, im Vergleich zu 86% beim CT.
- In Arentz et al. von der Washington State wurde gezeigt, dass nur 1 von 21 Patienten ein unauffäligen Befund des Röntgen-Thorax hatte. Allerdings wurden verschiedene Befunde detektiert (bilaterale retikuläre Verschattungen, milchglasartige Verschattungen, regionale Konsolidierungen und Lungenödem)
Weitere Informationen
- Ein Ratgeber zum CT-Thorax bei COVID-19 (PulmCCM, by Jon-Emile Kenny)
Lungen-Ultraschall
Technik
- Um gute Sensitivität zu erreichen muss man eine gründliche Untersuchung durchführen (“Rasenmäher”-Methode um so viel Lungengewebe wie möglich darzustellen).
- Ein linearer Schallkopf kann für hochauflösende Bilder empfehlenswert sein (um einen Unterschied zwischen einer glatten normalen Pleuralinie zu einer verdickten und irregulären Pleuralinie zu sehen).
- COVID-19 macht typischerweise unregelmäßige Abnormalitäten im CT. Diese werden übersehen außer wenn Ultraschall über dem normalen Lungengewebe durchgeführt wird.
- 5 Minute Sono – Viral Pneumonia from Jacob and Mike on Vimeo
Befunde
- Die Befunde des Lungenultraschalls scheinen sehr gut mit den Befunden des CTs zu korrelieren.
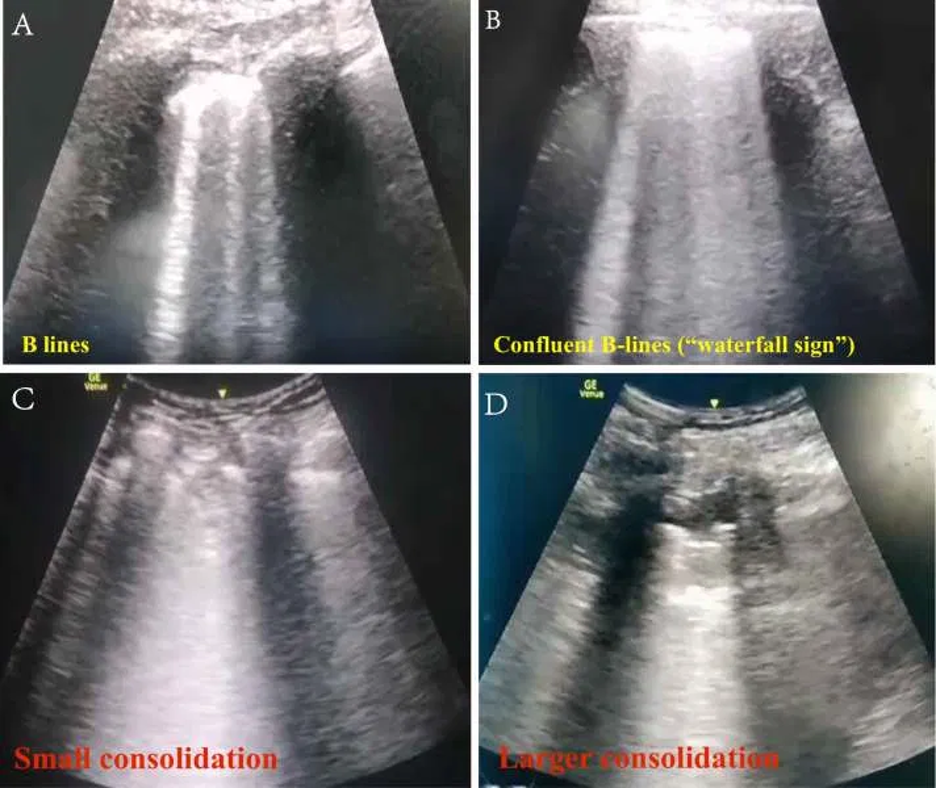
- Mit Zunahme der Schwere der Erkrankung kann man die folgende Entwicklung sehen (siehe dazugehörige Bilder weiter unten) (Peng 2020)
- (A) Wenig schwerer Befund: Milde milchglasartige Trübungen im CT korrelieren zu vereinzelten B-Linien.
- (B) Mehr zusammenfließende milchglasartige Trübungen im CT können korrelieren mit zusammenwachsenden B-Linien (“Wasserfall-Zeichen”).
- (C) Bei schwererer Erkrankung sind kleine periphere Konsolidierungen im CT und Ultraschall zu sehen.
- (D) Bei der schwersten Form nimmt das Volumen der konsolidierten Lunge zu.
- 👁 Bilder zu diesen Befunden hier.
- Andere Besonderheiten:
- Periphere Lungen-Abnormalitäten können eine Unterbrechung oder Verdickung der Pleuralinie verursachen.
- Gebiete mit normaler Lunge (mit A-Linien-Muster) können zu Beginn der Erkrankung oder bei bereits eingetretender Erholung gesehen werden.
- Kleine Pleuraergüsse können gesehen werden, aber größere Pleuraergüsse sind selten (Peng 2020).
- Wie beim CT zeigen sich abnorme Befunde meist in den posterioren und inferioren Bereichen der Lunge.
- Sehr gute Beispiele für die Korrelation von CT-Bildern zu Bildern des Lungenultraschalls sieht man hier.
Performance
- Die Sensitivität des Lungenultraschalls ist nicht eindeutig definierbar.
- Sensitivität hängt ab von mehreren Faktoren (Schwere der Erkrankung, Vorhandensein von Adipositas und Gründlichkeit des Scannens).
- Meine Vermutung ist, dass eine gründliche Ultraschall-Untersuchung eine Sensitivität irgendwo zwischen CT und Röntgen-Thorax hat (z.B. vielleicht eine Sensitivität von ~75%?) (Huang et al.). Es gibt keine verlässlichen Daten bisher, aber es ist wahrscheinlich angemessen, von unseren Erfahrungen bei anderen Pneumonie-Arte zu extrapolieren.
- Spezifität ist sehr niedrig. Eine lückenhafte B-Linie oder ein Konsolidierungs-Muster kann man in jeder Pneumonie oder bei interstitieller Lungenerkrankung sehen. Allerdings ist eine klinische Korrelation notwendig (z.B. Vergleich mit Voraufnahmen, um chronische Veränderungen zu erkennen).
- Es kann möglich sein, dass hospitalisierte Patienten B-Linien und Konsolidierungen in posteriorem oder inferiorem Bereich haben, die durch Atelektasen hervorgerufen sind. Der Lungenultraschall hat vermutlich die beste Sensitivität und Spezifität bei ambulanten Patienten.
Genereller Ansatz zur Bildgebung
Alle Bildtechniken sind unspezifisch
- Alle oben genannten Techniken (Rö-Tx., CT, Ultraschall) sind nicht-spezifisch. Lückenhafte milchglasartige Trübungen können von vielen anderen Erkrankungen hervorgerufen werden (z.B. virale und bakterielle Pneumonien).
- Die Bildgebung kann nicht zwischen COIVD-19 und anderen Formen einer Pneumonie unterscheiden.
- Bildgebung könnte helfen, zwischen COVID-19 und anderen nicht-pulmonalen Störungen zu unterscheiden (z.B. Sinusitits, nicht-pulmonale virale Erkrankung).
- Letztendlich ist die Bildgebung nur ein Teil der Gesamtinformation, welche man in den klinischen Kontext einordnen muss.
Mögliche Ansätze für Bildgebung bei COVID-19
- Eine mögliche Strategie bei Patienten, die sich mit respiratorischen Symptomen und V.a. COVID-19 vorstellen wird unten aufgezeigt.
- Der Versuchung, bei jedem Patienten eine CT durchzuführen, sollte man widerstehen. In den meisten Fällen wird dies vermutlich wenig zusätzliche Information zu Röntgen-Thorax und Lungenultraschall beitragen (in Bezug auf umsetzbare Daten, die das Management des Patienten beeinflussen). (Kommentar: Je nach lokalem Ablauf kann durchaus die rasche initiale CT-Bildgebung in einem „Infekt-CT“ höherwertige Informationen als ein Röntgen-Thorax geben. Regelhaft primär Röntgen und dann erst CT macht allein aus Infektionsschutzgründen keinen Sinn.)
- Aus der Perspektive der Intensivmedizin wird der CT-Befund das Management dieser Patienten nur wenig beeinflussen (alle von ihnen werden diffuse Infiltrate haben).
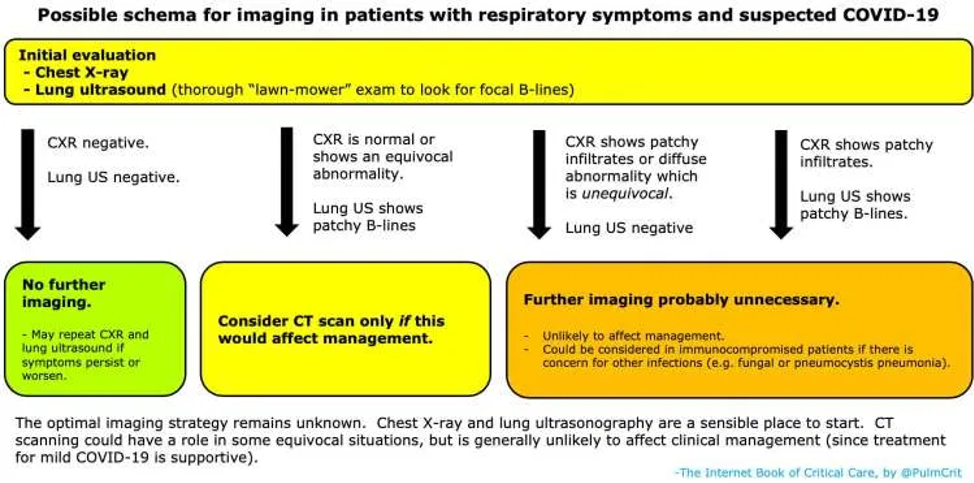
Mehr Information:
- RSNA focus page on coronavirus (beinhaltet tolle Diashow, die mögliche Befunde in der Bildgebung in wenigen Minuten zusammenfasst).
Bronchoskopie
- Risiken einer Bronchoskopie:
- Könnte eine Verschlechterung der klinischen Situation verursachen (durch Applikation von Kochsalzlösung und durch Sedierung).
- Sehr hohes Risiko der Virusübertragung für die Untersucher.
- Verbrauch von Ressourcen (benötigt FFP2-Maske, Beatmungsmaschine, ärztliches Personal, Assistenz) – alles Ressourcen, die während einer Epidemie knapp sind.
- Vorteile einer Bronchoskopie:
- Der Vorteil COVID-19 derart zu diagnostizieren, ist zu bezweifeln (vorausgesetzt, dass die Behandlung in erster Linie supportiv ist).
- Fazit bezüglich Bronchoskopie?
- Bronchoskopie sollte in Erwägung gezogen werden, wenn es auch in vergleichbaren Situationen durchgeführt würde (z.B. Patient mit Immunsuppression und V.a. Pneumocystis-Pneumonie bzw. Pilz-Pneumonie).
- Bronchoskopie sollte nicht zur Bestätigung oder zum Ausschluss von COVID-19 durchgeführt werden (da dann die Risiken bei fehlendem sicheren Benefit überwiegen) (Bouadma et al.).
Wie man stationär aufgenommene Patienten am besten abklärt.
👁 Checkliste für Tests, die man sich überlegen sollte wenn man einen Patienten mit respiratorischem Versagen und V.a. COVID-19 behandelt.
👁 Möglicher diagnostischer Flowchart bei einem Patienten, der mit V.a. COVID-19 in ein Krankenhaus aufgenommen wird.
- Dieser Ansatz setzt voraus, dass ein PCR-Assay für COVID-19 vorhanden ist, mit dem in kurzer Zeit ein Ergebnis bestimmt werden kann.
- Eine negative Influenza-PCR vor COVID-19-Testung zu verlangen ist nicht zielführend, da es ~5% der Patienten mit einer Ko-Infektion geben kann (Wang et al.). Daher kann eine positive Influenza-PCR nicht COVID-19 ausschließen. Die Anzahl der Co-Infizierten kann im Verlauf weiter ansteigen, wenn die Prävalenz von COVID-19 ansteigt.
- Die größte Herausforderung wird sein, zu bestimmen, wer für die Diagnostik von COVID-19 in Frage kommt (d.h. wer muss überhaupt in diesen Algorithmus aufgenommen werden). Aktuell gibt es dafür keine einfache Antwort – klinisches Gespür ist dafür notwendig. Wenn man bei zu vielen Patienten COVID-19 verdächtigt, wird man viele Materialien wie Masken verbrauchen, auch bei Patienten, die nicht mit COVID-19 infiziert sind. Zusätzlich wird durch Vorsichtsmaßnahmen die Versorgung von Patienten verschlechtert (z.B. führt Isolation zu einer größeren Hemmschwelle, Untersuchungen durchzuführen oder Besuch zu erlauben).
- Zu wenig Patienten abzuklären kann zu nosokomialen Ansteckungen von COVID-19 führen.
Vorgehen bei hypoxämischen, nicht intubierten Patienten
- Tägliche Untersuchungen
- Die körperliche Untersuchung bringt eher keinen zusätzlichen Erkenntnisgewinn bei Patienten, die geistig klar sind und ihre Symptome selber gut berichten können.
- Vermeidung das Stethoskop zu benutzen! Diesem können Keime anheften und somit zur weiteren Ansteckung führen.
- Herz- und Lungenultraschall kann zur Evaluation von Änderungen des klinischen Bildes wenn indiziert durchgeführt werden. Lungenultraschall (und nicht Auskultation) ist die zu präferierende Methode um den Lungen-Status zu evaluieren.
- Labor
- Täglich
- Elektrolyte, Creatinin, Magnesium, Phosphat
- kleines Blutbild und Diff.-BB
- Regelmäßiges Labor (all 48 h):
- D-Dimer
- CRP
- Ferritin, LDH
- Troponin (B&W Leitlinien)
- (Aufnahme Labor: die oben genannten Werte plus: Urin-Schwangerschaftstest bei Frauen in entsprechendem Alter
- 2 Paar Blutkulturen
- Tracheales Aspirat für Mikrobiologie
- Urin: Legionellen & Pneumokokken Antigen
- Leberwerte
- Gerinnung incl. INR, PTT, Fibrinogen
- Kardiovaskulär:
- Es sollte eine ausgeglichene oder negative Flüssigkeitsbilanz angestrebt werden. Flüssigkeitsboli sollten vermieden werden (mehr dazu hier und hier).
- Keine über einen längeren Zeitraum fest angesetzte i.v.-Flüssigkeitsgabe (ANZICS Leitlinien).
- Erwägung, Dauermedikation von Antihypertensiva zu pausieren (insbesondere ACE-Hemmer oder AT1-Blocker). (Kommentar: Das empfiehlt die ESC nicht!)
- Pulmonal:
- Es gibt verschiedenste regional unterschiedliche Strategien zur Sauerstoffgabe.
- Aktuell werden von allen Leitlinien HFNC als beste Alternative angesehen, wenn low-flow Sauerstoff nicht mehr ausreichend ist (u.B. SSC campaign, ANZICS). Dabei sollte gutes Monitoring etabliert werden und Vorkehrungen zur Vermeidung von Keimübertragung über den Luftweg getroffen worden sein.
- Die Hemmschwelle zu intubieren sollte niedriger als bei anderen Patienten mit respiratorischem Versagen sein. Rechtzeitige Absprache mit der Intensivstation ist für Patienten mit steigendem Sauerstoffbedarf essentiell.
- Vorgehensweisen zu Therapien zur Unterstützung bei respiratorischer Insuffizienz werden weiter unten besprochen.
- Überprüfung von portablen Röntgen-Thorax nur nach klinischer Indikation.
- Ziel für die Sauerstoffsättigung ist für die meisten Patienten ~92-96% (zu viel Sauerstoff kann auch schaden und es kann zu einem Verlust des Sauerstoffvorrats der Klinik führen) (SSC Leitlinien).
- Vermeidung von Vernebeln zur Bronchodilatation. Dieses sollte nur verwendet werden wenn es tatsächlich indiziert ist.
- Statt Vernebeln können Sprays zur Inhalation verwendet werden (4-8 Hübe entsprechen ungefähr einmal Vernebeln).
- Renal
- Vermeidung von nephrotoxischen Substanzen (vor allem NSAR).
- Ausreichende Supplementation von K, Mg bei Patienten die mit QT-verlängernden Medikamenten behandelt werden (z.B. Chloroquin, Hydroxychloroquin).
- Infektiöse Erkrankungen:
- Zu Beginn werden die meisten Patienten empirisch Antibiotika für bakterielle Pneumonie erhalten (z.B. Azithromycin plus Ceftriaxon).
- Anti-virale Therapie wenn vorrätig (z.B. Hydroxychloroquine oder Remdesivir).
- Mikrobiologische Befunde sollten Beachtung finden.
- Blut:
- Thromboseprophylaxe (fortführen außer wenn Thrombozyten <30 sind, da COVID-19-Patienten die pro-koagulatorische Form einer DIC trotz niedriger Thrombozyten entwickeln können) (B&W Leitlinien).
- Vorsichtige Strategie bzgl. Transfusionen (im Allgemeinen sollte keine Transfusion durchgeführt werden außer Hb <7 mg/dL, oder <8 mg/dL mit Anzeichen einer akuten myokardialen Ischämie). Es sollten Diuretika zur Transfusion in Erwägung gezogen werden, um eine ausgeglichene Flüssigkeitsbilanz zu erzielen.
- Neurologie:
- Für antipyretische und analgetische Effekte zu erzielen kann man 1 g Paracetamol alle 6 Stunden verwenden.
- Melatonin 5 mg zur Nacht zum Schlafen.
- Vermeidung von NSAR (kann nephrotoxisch wirken und möglicherweise den ACE2-Rezeptor hochregulieren und so die Infektion verschlechtern)
Vorgehen bei intubierten Intensiv-Patienten
- täglicher Fokus auf:
- Einstellungen des Beatmungsgeräts & Synchronisierung mit dem Beatmungsgerät.
- Bestätigung der Tubuslage obere Zahnreihe (damit kein Veränderung der Tubuslage stattfindet).
- Straffen / Abkleben der Verbindungen zwischen Tubus, Schläuchen und Beatmungsgerät (damit keine versehentlichen Diskonnektionen auftreten).
- Neurologischer Status
- Kardialer- und Lungen-Ultraschall (wenn eine entsprechende klinische Frage besteht)
- Vermeidung des Stethoskop-Gebrauchs (dieses kann keimbehaftet sein und zum Risiko einer Übertragung beitragen).
- Labor:
- Tgl. Labor:
- Elektrolyte, Creatinin, Magnesium, Phosphat
- Blutbild mit Diff.-BB
- Gerinnung (INR, PTT, fibrinogen, D-dimer).
- Hämophagozytische Lymphohistiozytose-Werte (CRP, Ferritin, LDH).
- Troponin (zur Überwachung der Entwicklung einer Myocarditis, nicht für akutes Koronarsyndrom).
- Intermittierende Blutwerte:
- Triglyceride alle 72 Stunden bei Patienten, die Propofol bekommen (Überwachung für Propofol-Infusions-Syndrom).
- Leberwerte jd. 2. Tag (bzw. tgl. bei Patienten, die Chloroquin erhalten)
- Aufnahmelabor: alle der oben genannten plus:
- Urin-Schwangerschaftstest bei Frauen in entsprechendem Alter
- 2 Paar Blutkulturen
- Tracheales Aspirat für Mikrobiologie
- Urin: Legionellen & Pneumokokken-Ag
- Gerinnungslabor (INR, PTT, Fibrinogen)
- kardiovaskulär:
- Vermeidung von Flüssigkeitsboli (mehr dazu hier und hier) & Vermeidung von regelmäßgigen über einen längeren Zeitraum fest angesetzte i.v.-Flüssigkeitsgabe (ANZICS Leitlinien).
- Es sollte eine ausgeglichene oder negative Flüssigkeitsbilanz angestrebt werden.
- Verwendung von niedrigdosierten Vasopressoren wenn notwendig um MAP zu stützen.
- Erwägung von Pausieren von antihypertensiver Hausmedikation (insbes. ACE-Hemmer oder AT-1-Blocker).
- Pulmonal:
- Lungen-protektive Beatmung
- Erwäge frühzeitig APRV (falls das Haupt-Problem Atelektasen sind, die APRV gut behandelt)
- Wenn APRV nicht verfügbar ist oder keine Erfahrung besteht: Niedrige Tidalvolumina mit hohem PEEP (siehe Abschnitt zur invasiven Beatmung weiter unten)
- Gastrointestinal:
- Enterale Ernährung.
- Stressulkusprophylaxe.
- Renal:
- Vermeidung von nephrotoxischen Substanzen (vor allem NSAR).
- Diuretika wenn notwendig, um ausgeglichene Flüssigkeitsbilanz zu erreichen (wenn dies hämodynamisch toleriert wird).
- Ausreichende Supplementation von K, Mg bei Patienten die mit QT-verlängernden Medikamenten behandelt werden (z.B. Chloroquin, Hydroxychloroquin).
- Infektiöse Erkrankungen:
- Zu Beginn werden die meisten Patienten empirisch Antibiotika für bakterielle Pneumonie erhalten (z.B. Azithromycin plus Ceftriaxon). (Kommentar: Im deutschsprachigen Raum eher bsp. Ampicillin/Sulbactam oder Piperacillin/Tazobactam plus Clarithromycin)
- Vermeide Vancomycin. Meist haben die Patienten kein MRSA aber sie entwickeln oft Niereninsuffizienz! Wenn MRSA-Behandlung indiziert, erwäge Linzolid.
- Anti-virale Therapie wenn vorrätig (a.e. Hydroxychloroquine oder alternativ Remdesivir). (Kommentar: Hier besteht aktuell keine Evidenz!)
- Mikrobiologische Befunde beachten.
- Blut:
- Thromboseprophylaxe (fortführen außer wenn Thrombozyten <30 sind, da COVID-19-Patienten die pro-koagulatorische Form einer DIC trotz niedriger Thrombozyten entwickeln können) (B&W Leitlinien).
- Vorsichtige Strategie bzgl. Transfusionen (im Allgemeinen sollte keine Transfusion durchgeführt werden außer Hb <7 mg/dL, oder <8 mg/dL mit Anzeichen einer akuten myokardialen Ischämie). Es sollten Diuretika zur Transfusion in Erwägung gezogen werden, um eine ausgeglichene Flüssigkeitsbilanz zu erzielen.
- Erwäge Antikoagulation für DIC (sehr geringe Evidenz!) Patienten mit D-Dimer >2000 ng/ml könnten von therapeutischer Antikoagulation z.B. mit niedermolekularem Heparin profitieren.
- Endokrin:
- Regelmäßige Blutglucose-Kontrollen.
- Insulingabe zur Vermeidung schwerer Hyperglykämien.
- Neurologie:
- Paracetamol 1 g p.o. alle 6 Stunden (für antipyretische und analgetische Effekte).
- Opioid Bolus b. Bed. (z.B. Fentanyl 50 mcg i.v. alle 30 min. b. Bed. bis der Schmerz durchbrochen ist).
- Propofol niedrig-dosiert als titrierbares Sedativum (z.B. idealerweise 0-40 mcg/kg/min).
- Melatonin 5 mg zur Nacht zum Schlafen.
- Erwägung von zusätzlichen atypischen Antipsychotika zur Nacht und ggf. basale Sedierung (z.B. Olanzapin 5-10 mg z.N.)
- Bei persistierendem Schmerz kann zusätzlich eine Ketamininfusion gegeben werden (0.1-0.3 mg/kg/hr) (mehr dazu hier).
- Vermeidung von NSAR (kann nephrotoxisch wirken und möglicherweise den ACE2 Rezeptor hochregulieren und so die Infektion verschlechtern)
- (Dexmedetomidin kann vor dem Extubationsversuch zur Anxiolyse bei Spontanatemversuch eingesetzt werden.)
- Zugänge:
- (1) Orogastrale Sonde oder schmalkalibrige post-pylorische Sonde.
- (2) ZVK. Niedrige Hemmschwelle, einen 4-lumigen ZVK unter strengen sterilen Bedingungen zu legen.
- Beste Zugangsseite ist am ehesten die linke V. jug. int. (die rechte V. jug. int. sollte für Zugänge von Kathetern für Dialyse oder ECMO vorgehalten werden).
- (3) Arterieller Zugang: Wenn möglich, sollte dies vermieden werden, da dieses dazu verleitet, regelmäßige art. BGAs / venöse BGAs zu entnehmen (da es unwahrscheinlich zu einer besseren Versorgung führt und potentiell zur einer Anämie führen kann).
Hintergrund zu anti-viraler Therapie
- Wann ?
- Retrospektive Daten von SARS empfehlen einen frühen Beginn der Behandlung (z.B. innerhalb von 1-2 Tagen nach Aufnahme), dieses könnte effektiver sein als die Therapie bis zu schwerem Organversagen zurückzuhalten (Chan 2003). Dieses ist übereinstimmend mit Daten von Influenza, welches ein begrenztes Zeitfenster eher zu Beginn der Behandlung vorschlägt.
- Wer ??
- Der größte Teil der Patienten wird sich auch ohne Therapie gut erholen. In den meisten Fällen ist somit keine antivirale Therapie notwendig.
- Allerdings sollte man nicht warten bis Patienten schwer krank sind bevor man diese Therapie initiiert, da sich sonst das Zeitfenster schließt, in dem der Verlauf der Erkrankung besser beeinflussbar ist.
- Prädiktoren eines schlechten Outcomes können vorhersagen, wer am ehesten schwer betroffen sein wird und wer am meisten von früher antiviraler Therapie profitiert? (siehe Abschnitt weiter unten über Prognose).
Chloroquin und Hydroxychloroquin
Allgemeine Beschreibung
- Chloroquin wird normalerweise für die Behandlung von Malaria und Amöbiasis genutzt. Es hat in-vitro antivirale Aktivität, ist aber nicht etabliert in der Behandlung von Viruserkrankungen.
- Das Toxizitätsprofil scheint akzeptabel zu sein (z.B. wird es weit verbreitet als Malaria-Prophylaxe verwendet – allerdings deutlich niedriger dosiert als aktuell für die Behandlung von COVID-19 in Erwägung gezogen).
Wirkmechanismus
- Chloroquin scheint über mehrere Wirkmechanismen zu wirken, diese umfassen:
- Beeinflussung des zellulären Rezeptors ACE2 (potentiell besonders wirksam gegen SARS und COVID-19).
- Beeinträchtigung der Ansäuerung von Endosomen, dieses beeinflusst den Virustransport innerhalb der Zellen.
- Chloroquin zeigt immunsuppressive Aktivität. Es ist unbekannt, ob solch immunsuppressives Verhalten vorteilhaftoder schädlich sein kann (analog zur Steroid-Therapie).
in vitro Daten und Tierstudien
- In vitro Daten von Zelllinien zeigen, dass Chloroquin COVID-19 mit einer 50% Hemmkonzentration von 1 uM hemmen kann. Das bedeutet, dass therapeutische Level beim Menschen erreicht werden können (Wang 2020). Die 50% Hemmkonzentration des Chloroquin für SARS ist näher an 9 uM, daher ist zu vermuten, dass Chloroquin wirksamer gegen COVID-19 als gegen SARS ist (Al-Bari 2017).
- Chloroquin zeigte keinen Effekt in Mäusen, die mit SARS infiziert waren (Bernard 2006).
Daten aus Studien mit Menschen
- Gautret et al: Hydroxychloroquin und Azithromycin (Marseille Studie) Nicht-randomisiert, open label Studie, die den Gebrauch von Chloroquin (200 mg 3xtgl.) mit oder ohne Azithromycin (500 mg einmalig, dann 250 mg täglich für 4 Tage).
- Primärer Endpunkt war die Reduktion der Viruslast. Dieses konnte erreicht werden, insbesondere in der Kombination von Chloroquin mit Azithromycin.
- Limitierung der Studie waren Rückzug einiger Patienten aus der Hydroxychloroquin-Gruppe.
- Berichte aus China lassen vermuten, dass Chloroquin mit guten Ergebnissen angewendet wurde, allerdings sind keine belastbaren Daten vorliegend (Gao 2020). Eine Experten-Consensus-Gruppe in China empfiehlt eine Behandlung mit 500 mg p.o. 2xtgl. für Patienten ohne Kontraindikationen (Zhi 2020). Hoffentlich werden hierzu in Kürze bessere Daten veröffentlicht.
Dosierung (Medikamentenprofil von MedScape)
- Hydroxychloroquin (Profil MedScape)
- i) Loading dose: 400 mg p.o. 2xtgl. an Tag 1.
- ii) Erhaltungsdosis von 200 mg alle 12 Stunden für 5 Tage, am besten mit Nahrung einnehmen (so verwendet von U. Pennsylvania und Belgischen Leitlinien).
- Keine Dosisanpassung bei Nieren- oder Leberinsuffizienz oder Adipositas.
- Chloroquin (Profil MedScape) Wird allgemein als second-line betrachtet, da es eine erhöhte Toxizität als Hydroxychloroquin hat.
- 500 mg Chloroquinphosphat enthält 300 mg Chloroquin (alias Chloroquin base).
- 500 mg p.o. 2xtgl. für 10 Tage wird von einer Gruppe aus China für Patienten ohne Kontraindikationen empfohlen (Zhi 2020).
- Ggf. Dosisanpassung je nach Nieren- und Leberfunktion.
Indikationen ?
- Hydroxychloroquin sollte dringend in Erwägung gezogen werden für hypoxämische Patienten, die nicht in randomisierte Studien eingeschlossen werden können (B&W Leitlinien).
- Hydroxychloroquin oder Chloroquin wird in belgischen Leitlinien empfohlen.
Kontraindikationen/Warnungen für Hydroxychloroquin
- Kontraindikationen
- QT Verlängerung (ab QTc 450-500ms, tägliches EKG erwägen, Mg und K Spiegel halten)
- Epilepsie (erhöht Krampfschwelle)
- Porphyrie
- Myasthenia Gravis
- Retina-Pathologie
- G6PD Mangel
- Gefährliche Nebenwirkungen können sein – vor allem bei prolongierter Gabe:
- Torsades de Pointes
- Kardiomyopathie
- Knochenmarksupression (Thrombozytopenie, Leukopenie)
- Hypoglykämie (Vorsicht bei Patienten mit Diabetes)
weiterführende Informationen
- Medscape story über Hydroxychloroquingebrauch in Frankreich (dazu passendes Video).
Remdesivir
- Remdesivir könnte ein hervorragendes antivirales Medikament sein, wenn man sich in vitro -Studien und Daten von Tieren bei MERS anschaut (z.B. Sheahan 2020, Holshue 2020).
- Remdesivir ist nicht kommerziell zu erwerben. Man kann es von der Firma GILEAD on als therapeutischen Heilversuch („compassionate use“) bekommen oder verwendet es im Rahmen einer randomisierten Studie.
- Aktuelle Ausschlusskriterien sind u.a. Multiorganversagen, Notwendigkeit einer Katcholamintherapie, Creatinin-Clearance <30 ml/min, Transaminasen 5x über oberem Grenzwert oder gleichzeitige Verwendung anderer experimenteller antiviraler Medikamente (Belgische Leitlinie).
Andere Medikation
- Ascorbinsäure
- Ascorbinsäure scheint die Mortalität in dieser Multi-Center-Studie zu senken: CITRIS-ALI trial. Allerdings ist die Interpretation dieser Studie sehr umstritten aufgrund von schwierig zu lösender Fragen bzgl. des survival-ship Bias (Diskussion hier).
- Sehr begrenzte Evidenz lässt vermuten, dass Ascorbinsäure in Tierstudien mit Coronavirus vorteilhaft sein könnte (Atherton 1978).
- Verabreichung von moderaten i.v.-Dosen Vitamin C kann in Erwägung gezogen werden (z.B. 1,5 g Ascorbinsäure i.v. alle 6 Stunden plus 200 mg Thiamin i.v. alle 12 Stunden). Das scheint eine sichere Behandlung zu sein. Allerdings gibt es keine hohe Evidenz, dass Ascorbinsäure bei viraler Pneumonie wirksam ist.
- Lopinavir/Ritonavir (Kaletra)
- Dieses scheint nicht zu funktionieren und kann außerhalb einer Studie nicht empfohlen werden.
- Mehr zu Lopinavir/Ritonavir hier.
- Osemaltivir & andere Neuraminidase-Inhibitoren
- Neuraminidase-Inhibitoren scheinen nicht gegen COVID-19 zu wirken (Tan et al 2004).
- Initiale empirische Therapie mit Neuraminidase-Inhibitoren könnte während der Influenza-Saison vernünftig sein, wenn es Bedenken gibt, dass der Patient eine Influenza-Pneumonie hat.
- Aktuell kann noch in vielen Gegenden bei Patienten mit V.a. viraler Pneumonie Influenza wahrscheinlicher sein als COVID-19.
Krankheitsstadien und richtiges Timing der Therapie

- Die obige Abbildung ist ein Vorschlag von Siddiqi et al. Krankheitsverläufe können variieren, daher kann die Einteilung in Stadien herausfordernd sein. Allerdings bekommt man so eine gute konzeptionelle Vorstellung des Krankheitsverlaufs.
Stadium I: frühe Infektion
- Klinisch: Der Ansteckung folgen unspezifische Symptome (e.g. Abgeschlagenheit, Fieber, trockener Husten). Diese pahse kann mehrere Tage mit milden Symptomen andauern. Patienten benötigen häufig keine Aufnahme in die Klinik.
- Biologisch: Virale Replikation beginnt. Eine immanente Immunantwort folgt, aber dadurch kann das Virus nicht kontrolliert werden. Die Symptome reflektieren eine Kombination von direkten viralen zytopathischen Effekten und der immanenten Immunantworten (z.B. Typ-I Interferon Ausschüttung).
- Behandlung:
- Anti-virale Therapie könnte Vorteile bringen, besonders bei Patienten, die voraussichtlich ein erhöhtes Risiko für ein schlechtes Outcome haben. Anti-virale Therapie hat wahrscheinlich den besten Effekt wen man sie in der frühen Phase gibt.
- Interferon I-beta könnte in der Theorie gut dafür zu sein, die immanente Immunantwort auf das Virus zu modulieren. Dabei beeinflusst es Zellen, die resistent zu viraler Infektion ist, eine Intervention, die wahrscheinlich am effektivsten sein könnte, wenn sie so früh wie möglich durchgeführt wird (dieses ist allerdings eine theoretische Überlegung, welche akutell nicht empfohlen wird).
- Immunsuppression könnte in der Therorie zu diesem Zeitpunkt gefährlich sein, da es die Entwicklung einer adäquaten Immunantwort verzögern könnte. Zum Beispiel kann der frühe Gabe von Steroiden die Virusausscheidung bei SARS verlängern (Lee et al 2004)
Stadium II: pulmonale Phase
- Klinisch: Patienten können sich trotz stabiler Situation in Stadium I plötzlich verschlechtern, wenn sie in Stadium II kommen (häufig mit sich verschlechternden hypoxämischem respiratorischem Versagen). Patienten werden zu diesem Zeitpunkt häufig im Krankenhaus vorstellig. Sie können zügig zu einem ARDS fortschreiten, weshalb sie intubiert werden müssen. Entzündungsparameter sind mäßig erhöht (z.B. CRP, Ferritin).
- Biologisch: Eine angepasste Immunantwort beginnt, welche eine Reduktion des Virustiters zur Folge hat. Allerdings kann dieses auch zu erhöhten Entzündungsstufen und Gewebsschädigung führen.
- Behandlung:
- Antivirale Therapie könnte hilfreich sein (allerdings je später die antivirale Therapie begonnen wird, desto weniger effektiv ist sie wahrscheinlich).
- Ein wenig Immunsuppression könnte bei Patienten mit schwerer Beeinträchtigung hilfreich sein (z.B. moderate Steroidgabe für Patienten mit ARDS)
Stadium III: hyperinflammatorische Phase
- Klinisch: Patienten verschlechtern sich mit DIC und Multiorganversagen (z.B. vasodilatatorischer Schock, Myokarditis). Abnorme Laborwerte können D-Dimer, CRP und Ferritin sein. Patienten können zu Beginn in Stadium II gut auf Intubation und Beatmung ansprechen, aber schließlich entwickeln sie zunehmende Inflammation, welche zu klinischer Verschlechterung führen.
- Biologisch: Die angepasste Immunantwort entwickelt sich weiter zu einem immunopathologisch dysregulierten Cytokinsturm. Dieses ist am ehesten eine Form einer virus-induzierten Haemophagozytiscen Lymphohistiocytosis (HLH)(Mehta et al.).
- Behandlung:
- Alle Behandlungen aus Stadium II könen fortgesetzt werden (z.B. moderate Steroidgabe und antivirale Therapie).
- Aggressivere immunmodulatorische Therapie ist wahrscheinlich notwendig um die Patienten zu kontrollieren, die sich tief in der hyperinflammatorischen Phase befinden. Es gibt hierzu aber keine Daten. Mögliche Therapien inkludieren:
- Tocilizumab scheint aktuell die beste Behandlung zu sein, obwohl es auch andere Möglichkeiten wie Anakinra or Ruxolitinib gibt (Zandvakili 2018).
- Höhere Dosierungen von Steroiden (z.B. 100-125mg Methylprednisolon alle 6h für 1-3 Tage, dann wieder reduzieren)
- Weitere Diskussion über virus-induzierte HLH und mögliche Therapien hier.
Steroide
- Steroide sollten grundsätzlich nicht in der frühen Phase oder milder Erkrankung verwendet werden.
- Steroide können die Freisetzung von Viren verstärken, z.B. in der replikativen Phase (Lee 2004).
- Die meisten Patienten erholen sich ohne Spätschäden – daher profitieren sie natürlich auch nicht von Steroiden.
- Steroide sollten bei Patienten mit einer unabhängigen Begründung für Steroide genutzt werden, beispielsweise bei:
- Vasopressor-refraktärer Schock
- Asthma- oder COPD-Exazerbatio.
niedrigdosierte Steroide für Patienten mit ARDS
- Die Surviving Sepsis Campaign Leitlinien empfehlen Steroide bei intubierten Patienten mit ARDS.
- Zur Zeit kommt die beste Evidenz bei COVID-19 aus der Arbeit von Wu et al 3/13/20.
- Retrospektive, single-center Studie, die 201 Patienten mit COVID-19 Pneumonie untersuchte.
- Bei Patienten mit ARDS korrelierte der Gebrauch von Methylprednisolon mit geringerer Mortalität.
- Typischerweise werden Steroide bei den kränkesten Patienten eingesetzt, daher kann dieses zu einem Bias zu schlechtem Outcome bei Patienten mit Steroiden führen. Eine Korrelation in die andere Richtung wäre überraschend, so dass man zu dem Schluss käme, dass Steroide einen Benefit bringen könnten.
- Letztendlich könnte es sinnvoll sein, low-dose Kortikosteroide bei Patienten mit ARDS und erhöhten Entzündungsparamtern (z.B. CRP) einzusetzen.
- In China wurden typischerweise Dosierungen von Methylprednisolon 40-80 mg i.v. täglich für 3-6 Tage verwendet, dieses erscheint eine sinnvolle Dosierung (Shang et al. 2/29). Äquivalente Dosierungen von Dexamethason (7-15 mg tgl.) könnte einen Vorteil haben, da es weniger Flüssigkeitsretention bewirkt, da Dexamethasone weniger mineralocorticoide Wirkung zeigt. Diese Dosierung der Steroide ist diejeinge, die auch im DEXA-ARDS trial verwendet wurde.
- Grafik warum Dexamethason besser als andere Kortikosteroide bei ARDS sein könnte.
Mittlere Dosierung von Steroiden für Patienten mit refraktärem Zytokinsturm
- Manche Patienten entwickeln einen Zytokin-Sturm der sich durch progredient steigende Entzündungsmarker, Fieber und im Verlauf distributiven Schock zeigt.
- Dieses Stadium der Entzündung könnte auf niedrige Steroiddosierung (z.B. Methylprednisolon 60mg / Tag) nicht reagieren. Es könnte sein, dass höhere Dosierungen nötig sind (z.B. 100-125mg alle 6h für 1-3 Tage). Dafür gibt es aktuell keine Daten!
Tocilizumab
Basics
- Tocilizumab ist ein rekombinanter monoklonaler Antikörper welcher sich an Interleukin-6 (IL-6) Rezeptoren bindet und die Funktion blockiert.
- Tocilizumab wird am häufigsten zur Behandlung einer rheumatoiden Arthritis verwendet. Es kann auch zur Behandlung eines Zytokin-Release-Syndroms nach CAR-T Therapie verwendet werden.
- Am ehesten ist zu vermuten, dass Patienten mit COVID-19 von Tocilizumab profitieren, die einen Zytokinsturm entwickeln (incl. erhöhten Werten von IL-6, ein pro-inflammatorisches Zytokin).
Evidenz
- Bislang keine höhergradige Evidenz vorliegend.
- Tocilizumab wurde in Italien verwendet (podcast Discussionen diesbezüglich hier und hier).
- Fallserien aus China (Xu et al.)
- 21 hypoxämische Patienten wurden mit Tociliumab 400 mg i.v. behandelt (die meisten Patienten bekamen eine einmalige Gabe, aber drei Patienten erhielten zwei Gaben).
- Patienten schienen sich klinisch zu verbessern ohne rasche Reduktion der Entzündungsmarker. Keine unerwünschten Nebenwirkungen ergaben sich dabei.
Dosierung
- 4-8 mg/kg i.v. (commonly used dose is 400 mg)
- Gabe kann nach 12 Stunden wiederholt werden falls keine adäquate Besserung nach 1. Gabe. Gesamtdosierung sollte nicht mehr als 800 mg sein. (B&W Leitlinien)
Unerwünschte Nebenwirkungen
- Erhöhte GOT, GPT: häufig.
- Infusionsreaktion (~10% der Patienten) kann auch als anaphylaktische Reaktion imponieren.
- Erhöhtes Risiko bestimmter oppurtinistischer Infektionen (z.B. Tuberkulose oder invasive Pilzinfektionen).
- Spontane gastrointestinale Perforation.
Indikationen ???
- Unklar. Vermutlich sprechen folgende Marker für die Verwendung von Tocilizumab:
- ARDS, insbesondere wenn zunehmend schwer.
- Progressive Erhöhung von Entzündungsmarkern (z.B. CRP, Ferritin, wahrscheinlic IL-6 wenn dieses rasch gemessen werden kann). Fehlen einer deutlichen Ferritinerhöhung spricht deutlich gegen das Vorhandensein eines Zytokinsturms.
- Erhöhter Katecholaminbedarf, Schock.
- Zwei Zelllinien reduziert (“Bi-Zytopenie“ – z.B. Thrombozytopenie puls Leukopenie oder Thrombopenie plus Anämie).
- Persistierendes Fieber, welches refraktär auf Antipyretika ist.
- Klinische Verschlechterung trotz anderer supportiver Maßnahme (nicht erklärt durch ein anderes Ereignis, wie zum Beispiel eine Krankenhaus-assoziierte bakterielle Infektion) .
Siltuximab
- Alternatives Mittel mit ähnlichen klinischen Effekten (Anti-IL6 monoklonaler Antikörper)
- Dosierung 11 mg/kg i.v. 1x
- Häufige unerwünschte Nebenwirkungen: Ödeme (>26%), Respiratorisch Infekte, Pruritus oder Hautrötung (28%), Thrombozytopenie (8%), Hypotension (4%) (B&W Leitlinien).
Kardiovaskuläres System
Vermeidung von übermässiger Flüssigkeitsgabe
- Patienten sind selten im Schock bei Aufnahme (sogar bei kritisch kranken Patienten ist Blutdruck normal und Laktaterhöhung mild-moderat) (Yang et al 2/21).
- Insgesamt liegt die Anzahl der Sepsispatienten niedrig (<5%). Das Virus scheint im Allgemeinen nicht einen septischen Schock zu verursachen (natürlich können Patienten bei Superinfektion einen bakteriellen septischen Schock erleiden).
- Todesursache bei COVID-19 ist meistens ARDS – dieses kann man mit übermässiger Flüssigkeitsgabe verschlimmern.
- Vorsichtige Flüssigkeitsgabe könnte für Patienten mit Nachweis von Hypoperfusion und einer Anamnese für Hypovolämie bezogen auf den gesamten Körper (z.B. verlängerte Nausea/Erbrechen und Diarrhoe) in Erwägung gezogen werden.
- Weitere Diskussion in Bezug auf Flüssigkeitstherapie bei COVID-19 hier.
Troponin-Erhöhung
- Erhöhte Troponinwerte treten häufig auf (insbesondere hoch-sensitives Troponin). Bei nicht-Überlebenden steigt Troponin von Tag 4 bis 22 zunehmend an (Zhou et al. 2020).
- Potentielle Gründe bei COVID-19-Patienten für eine Troponin-Erhöhung können sein
- Myocardiale Verletzung (Troponinerhöhung ohne Symptome/EKG/Echo-Befunde hinweisend auf myokardiale Ischämie)
- Type-I MI (Plaqueruptur) – am ehesten der am wenigsten übliche Grund.
- Type-II MI (Stress MI)
- Stress Kardiomyopathie (a.k.a. Takotsubo Kardiomyopathie)
- Virale Kardiomyopathie
- Die Abklärung sollte sich auf EKG und echokardiografische Zeichen neben dem klinischen Kontext fokussieren.
- In den meisten Fällen wird eine spezifische Therapie eines akuten Koronarsyndroms nicht indiziert sein.
Kardiomyopathie
- Fulminante Kardiomyopathie kann vorkommen. Das kann ein Spätzeichen sein, das auftritt wenn Patienten sich vom Lungenversagen erholen.
- Kardiogener Schock scheint eine wichtige Todesursache zu sein, trägt zu ~7-33% der Todesfälle bei (Ruan 3/3/20).
- Es ist unklar, ob dieses durch eine virale Kardiomyopathie (Viren können aus myokardialem Gewebe gewonnen werden), Stress-Kardiomyopathie oder kardiale Dysfunktion bei Zyotkin-Sturm (könnte ein Zeichen einer Virus-verursachten Hämophagocytischen Lymphohistiocytosis sein) verursacht ist.
- Evaluation: EKG, Echokardiographie und Troponin, um auf akuten Koronarverschluss zu prüfen.
- Behandlung: Wenn andere klinische und Laborbefunde für Zytokinsturm / HLH, kann man eine Behandlung dieses Syndroms in Erwägung ziehen (z.B. mit Tocilizumab)
Arrhythmie ??
- Palpitationen wurden bei 7% der Patienten einer Kohorte ermittelt (Liu 2020).
- Ein große Serie berichtete von 17% Arrythmien bei Patienten, aber hat dies nicht genauer angegeben (Wang 2/7/30).
- Dises Studien hatten keine Kontrollgruppen, daher ist es unklar, zu welchem Ausmaß COVID die Arrythmien verursacht hat (oder ob die Arrythmien einfach in kranken Patienten auftraten).
Schock
- Selten bei Aufnahme vorliegend, aber dieses kann ein Spätzeichen bei kritisch kranken Patienten auf der ITS sein.
- Mögliche Gründe:
- Kardiogener Schock (d.h. Myokarditis)
- Sekundäre bakterielle Superinfektion mit septischem Schock
- Zytokinsturm / Haemophagocytische Lymphohistiocytose
- Lungenembolie
- Pulmonle hypertension aufgrund von deutlich erhöhten mittlerem Atemwegsdruck (z.B. PEEP oder APRV)
- Anaphylactische Reaktion auf Medikamente
- Evaluation:
- Komplettes septisches workup (z.B. Blutkulturen, Sputumkultur, Procalcitonin, Rö-Tx., Untersuchung der line sites)
- Bettseitiges Echokardiogramm und körperl. Untersuchung
- Beurteilung von seriellen Blutabnahmen (hemophagocytische Lymphohistiocytose-Laborwerte sollten regelmäßig gemessen werden).
- Behandlung:
- Vasopressor-Unterstützung Ultraschall-gesteuert und gesteurt durch körperliche Untersuchung.
- Empirische Antibiotikatherapie falls septischer Schock vermutet wird.
- Corticosteroid-Therapie könnte in Erwägung gezogen werden. (besonders wenn vasopressor-refraktär, oder wenn Sepsis oder Zytokinsturm wahrscheinlich ist).
zusätzliche Information:
- Zheng YY et al. COVID-19 and the cardiovascular system. Nature Reviews, 3/5/20.
- The Coronavirus Conundrum, Hypertension Edition (NephJC blog, by Matthew Sparks and Swapnil Hiremath et al.)
- Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Fang et al, Lancet 3/11/20.
High flow nasal cannula (HFNC)
Sicherheit von HFNC
- Es gibt Bedenken, dass HFNC das Risiko einer Virusübertragung erhöht. Aktuell gibt es hierzu allerdings keine Evidenz, die das stützt.
- Leitlinien, die HFNC empfehlen:
- ANZICS-Leitlinien zu COVID-19 geben an:
- „HFNC in der Intensiv: HFNC ist die empfohlene Therapie für Hypoxie für COVID-19, solang das Personal Schutzausrüstung gegen Übertragung via Luft trägt.“
- „Das Risiko für Übertragung via Umgebungsluft ist niedrig bei gut passenden neuen HFNC-Systemen wenn optimale Schutzausrüstung und andere Infektionsschutzmaßnahmen genutzt werden. Unterdruck-Räume sind zu bevorzugen.“
- Surviving Sepsis Leitlinien geben an „Für akutes hypoxämisches respiratorisches Versagen empfehlen wir eine HFNC statt konventioneller Sauerstofftherapie“ (schwache Empfehlung, niedriges Evidenzlevel)
- WHO Leitlinien zu COVID-19 geben hierzu an, dass “aktuelle Publikationen vermuten lassen, dass HFNC- und NIV-Systeme mit guter Anpassung keine weit verbreitete Verteilung der Ausatemluft mit einem geringen Risiko einer Übertragung durch die Luft” zur Folge haben.
- ANZICS-Leitlinien zu COVID-19 geben an:
- Gründe, dass HFNC nicht die virale Übertragung steigert:
- HFNC läuft mit einer Rate von ~40-60 Liter pro Minute, wobei ein normaler Hustenstoss eine Flussrate von ~400 Litern pro Minute hat (Mellies 2014). Daher ist es zweifelhaft, dass ein Patient mit HFNC ansteckender ist als ein Patient mit normaler Nasenbrille, der hustet.
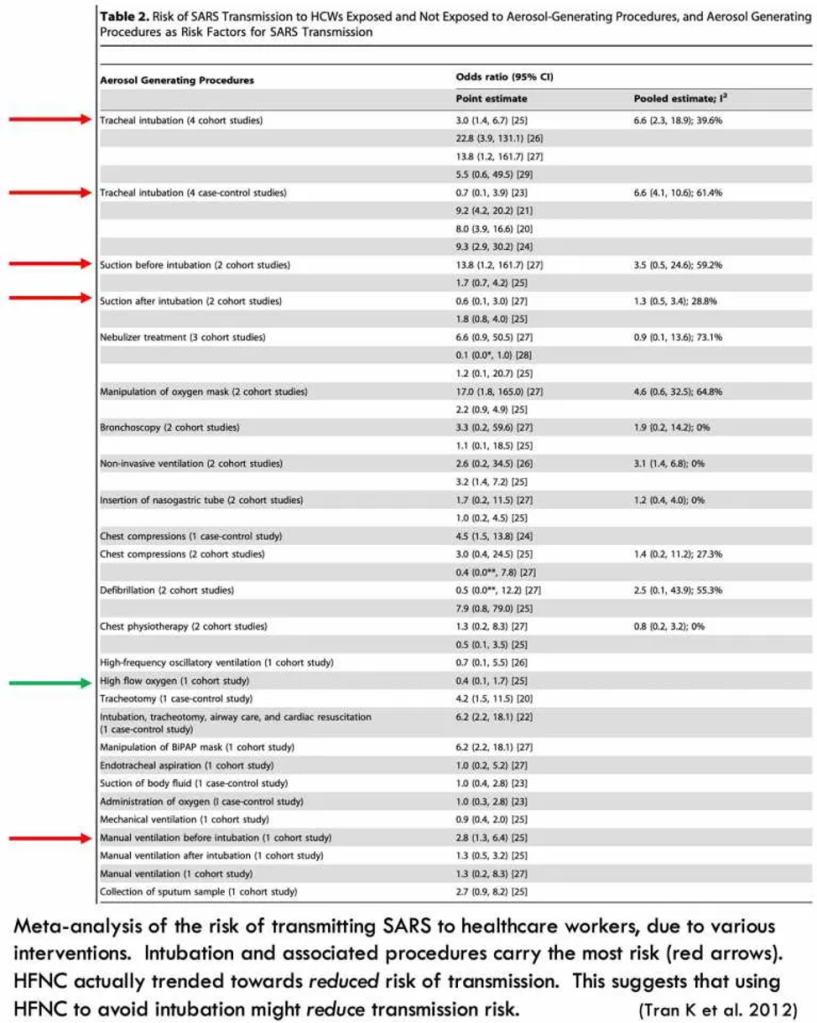
- HFNC braucht in der Regel weniger Pflege als eine invasive maschinelle Beatmung. Ein Patient mit HFNC, der Fernsehen schauen kann, verbreitet das Virus schlechter als ein intubierter Patient, dessen Beatmungsmaschine alle 15 Minuten alarmiert, und der endotracheales Absaugen und somit mehrere Behandler im Raum benötigt.
- Die Intubation birgt enorme Risiken für die Ausführenden. Es ist kontraproduktiv, eine Intubation mit dem Ziel einer Reduktion der Virusübertragung durchzuführen. (siehe Bilder von Tran 2012).
- Nach aktuellem Evidenz-Stand werden durch Therapie mit HFNC nicht substantiell Keime verbreitet (Evidez ist allerdings dürftig). In diesem Zusammenhang sei auf eine kleine Studie mit Patienten mit bakterieller Pneumonie (Leung 2018) und einen Abstract bzgl. Ausbreitung von Partikeln bei Freiwilligen (Roberts 2015) verwiesen.
- Ein möglicher Kompromiss könnte der Gebrauch von HFNC mit einer moderaten Flussrate sein (z.B. 15-30 Liter/Minute statt 40-60 Liter/Minute). Da 15-30 Liter/Minute Fluss knapp am Ausgangswert der Atmung eines kranken Patienten mit respiratorischem Versagen ist, sollte dieser zusätzliche Flow keine substantielle Änderung hervorrufen.
Evidenz der HFNC bei COVID-19
- HFNC ist im Allgemeinen eine vernünftiger Beginn einer nicht-invasiven Unterstützung bei Patienten mit ARDS (siehe auch FLORALI trial).
- Eine Fallserie aus China lässt vermuten, dass HFNC mit einer höheren Überlebensrate assoziiert ist im Vergleich zu anderen nicht-invasiven oder invasiven Beatmungsformen (natürlich kann dieses auch dadurch bedingt sein, dass es bei weniger kranken Patienten verwendet wird) (Yang et al, siehe Tabelle 2).
- Als Strategie bei COVID-19 wird von einer französischen Gruppe HFNC statt BiPAP präferiert (Bouadma et al.).

Nichtinvasive Beatmung
Traditionelle NIV ist wahrscheinlich nicht sinnvoll für die meisten Patienten
- Gründe die gegen NIV sprechen:
- In einer Multicenter-Kohorte von 302 Patienten mit MERS-Coronavirus hatten 92% der Patienten, die mit NIV behandelt wurden, ein NIV-Versagen und mussten intubiert werden (Alraddadi 2019).
- In der FLORALI Studie von ARDS-Patienten (meistens Pneumonien unterschiedlicher Ätiologie), hatten Patienten randomisiert zu NIV ein schlechteres Outcome als diejenigen, die zu HFNC randomisiert wurden.
- NIV könnte eine kleine Rolle spielen bei speziellen Patientensubgruppen mit kombinierten Syndromen (z.B. COPD plus COVID-19). Über die Auswahl NIV vs. HFNC, siehe dieses Kapitel über nicht-invasive Beatmung.
- Wenn NIV verwendet wird, sollte ein Filter mit Virenschutz etabliert sein, so dass die Kontamination der Umgebung verringert wird.
CPAP könnte die beste Form einer NIV-Beatmung sein ??
- Atelektasen, die zu einer Hypoxämie führen, können ein großes Problem in diesem Patientenkollektiv sein.
- Bild eines zunehmenden Alveolarkollapses.
- CPAP könnte hier große Vorteile haben:
- CPAP kann den größten Anteil von mittlerem Atemwegsdruck und somit das effektivste Recruitment erreichen.
- Bild das Atemwegsdruck CPAP vs. BiPAP vergleicht (Kommentar: Mit BiPAP bezeichnen die amerikanischen Kollegen eine NIV-Beatmung mit PEEP und Druckunterstützung z.B. „CPAP+ASB“)
- CPAP verändert nicht das Tidalvolumen, daher könnte es mehr lungenprotektive Beatmung zur Folge haben.
- CPAP kann den größten Anteil von mittlerem Atemwegsdruck und somit das effektivste Recruitment erreichen.
- Möglicher Ansatz CPAP-Therapie bei COVID-19:
- Steigerung des CPAP-Drucks auf 15-18 cm falls dies toleriert wird.
- Titration von FiO2 passend zur Sauerstoffsättigung. Fallendes FiO2 spricht für die Notwendigkeit, effektives Recruitment durchzuführen, wobei steigender FiO2-Bedarf CPAP-Versagen vermuten lässt.
- Beachte Tidalvolumina und Atemminutenvolumen.
- Bild welches zeigt wie ein nichtinvasives Beatmungsgerät zum Monitoring verwendet wird.
- Weitere Diskussion bzgl. CPAP bei COVID-19.
- https://twitter.com/drmarcogarrone/status/1241248307101552640/photo/1
NIV mit Helm
- Ein Helm kann mehrere Vorteile mit sich bringen:
- Könnte die Kontamination der Umgebung reduzieren (Cabrini 2020).
- Geringeres Risiko einer Aspiration bei Erbrechen.
- Verbessertes Outcome in einer randomisierten Studie bei ARDS-Patienten (Patel 2016).
- Leider gibt es nur begrenzten Zugriff auf dieses Material in den USA. Man könnte im Mac-Gyver-Style einen NIV-Helm basteln.
Sicherheit bei Gebrauch von CPAP und NIV
- Virenfilter sind essentiell, um ein geschlossenes System zu erzeugen und Übertragung zu begrenzen.
- Wenn eine Beatmungsmaschine mit einem zwei-Schlauch-System verwendet wird, dann können Virenfilter in-line mit dem Ausatemstück platziert werden.
- Wenn ein NIV-Gerät ein Ein-Schlauch-System besitzt, kann der Virenfilter direkt an die Maske angeschlossen werden.
- Verbesserter Maskenschluss kann die Sicherheit verbessern. Helme können theoretisch einen Vorteil dabei haben.
- Kommentar: Achtung – man sollte prüfen ob die Luftansaugung für das NIV-Gerät einen Filter besitzt! Sonst besteht bei der Ansaugung von (potentiell kontaminierter) Umgebungsluft das Risiko einer Kontamination des Geräts!
Wache Bauchlagerung („Awake prone positioning“)
- Basis:
- Betrifft einen nicht-intubierten Patienten mit O2 via Nasenbrille der sich selbst auf den Bauch legen kann.
- Kann mit verschiedenen nichtinvasiven Beatmungsformen kombiniert werden (normale Sauerstoff-Nasenbrille, HFNC, CPAP / NIV)
- Nur bei wachen, orientierten und kooperativen Patienten
- Kann besonders in Situationen hilfreich sein, wenn keine ausreichende Kapazität für invasive Beatmung zur Verfügung steht.
- Physiologie – warum funktioniert das?
- Gleiche Physiologie wie bei Bauchlagerung von intubierten Patienten („Bauchlage ist Bauchlage“). Beispielsweise:
- Könnte Sekretmobilisation verbessern
- Könnte basale Atelektasen rekrutieren (das scheint eines der zentralen Problemen für COVID-19-Patienten sein)
- Bauchlagerung bei intubierten Patienten ist weitverbreitet als erfolgreiche Therapie. Daher kann ein ähnlicher Erfolg auch bei nicht intubierten Patienten extrapoliert werden.
- Wache Bauchlagerung wird von Sun et al. als eine Technik empfohlen, um Intubation für COVID-19 Patienten zu vermeiden.
- Ablauf:
- Helfe dem Patienten sich auf den Bauch zu legen.
- Beachte, dass wichtige Geräte (Nasenbrille etc.) gut am Patienten fixiert sind, z.B. Nasenbrille mit Leukoplast / Tegaderm befestigen.
- Motiviere den Patienten für möglichst lange Bauchlagerung (optimalerweise 12-18h / Tag), das kann für einige Patienten schwierig sein
- Beachte die Oxygenierung und FiO2-Bedarf. Optimalerweise sollte eine Verbesserung der Oxygenierung innerhalb einiger Stunden zu beobachten sein. Wenn keine Verbesserung der Oxygenierung beobachtet wird, dann könnte wiederholte Bauchlage weniger Effekt haben.
- Gleiche Physiologie wie bei Bauchlagerung von intubierten Patienten („Bauchlage ist Bauchlage“). Beispielsweise:
Weiterführende Informationen:
Bauchlagerung für Nicht-intubierte Patienten (Pulmcrit Blog)
Schema für nicht-invasive Beatmung

Allgemeine Anmerkungen
- Viele “Regeln” sind bzgl. COVID-19 im Umlauf (z.B. man darf keine HFNC verwenden). Diese erscheinen nicht Evidenz-basiert oder durch Leitlinien unterstützt.
- Patienten haben unterschiedliche Voraussetzungen, daher ist immer gesunder Menschenverstand gefragt.
- Wenn man jeden Patienten, der > 6 Liter O2 benötigt, intubiert, wird dieses die ITS-Kapazität überbeanspruchen und führt zu unnötigen Intubationen. Bei jedem Patienten mit einem Ein-Organ-Versagen, der sich noch wohl fühlt und nur einen moderaten Sauerstoffbedarf hat, sollte man versuchen, eine Intubation zu vermeiden.
Indikation für eine Intubation?
- COVID-19 kann eine Hypoxämie mit relativ wenig respiratorischer subjektiver Beeinträchtigung verursachen (“stumme Hypoxämie”). Zum Beispiel können Patienten durchaus deutlich hypoxämisch sein, aber nicht über Dyspnoe klagen – solche Patienten können “unauffälig” ausschauen. Daher gilt: Atemarbeit kann nicht als einziges Alarmzeichen eines HFNC-Versagens angenommen werden.
- Es sollte eine niedrigere Hemmschwelle geben, Patienten mit COVID-19 zu intubieren als bei den meisten anderen Patienten. Gründe hierfür sind:
- Patienten können “stumme” Atelektasen entwickeln und sich trotz oligosymptomatischer Klinik rasch verschlechtern.
- Techniken während der Intubation, die eine suffiziente Oxygenierung gewährleisten sollen (z.B. Maskenbeatmung) können die Abgabe von Viren durch die Luft verursachen. Daher ist “pure” Rapid Sequence Intubation (RSI) ohne Maskenbeatmung zu präferieren. Dieses ist sicherer, wenn der Patient noch mit mehr Sauerstoffreserve beginnt.
- Intubation benötigt eine gute Vorbereitung, daher ist eine semi-elektive Intubation einer Crash-Intubation vorzuziehen.
- Es bleibt eine klinische Entscheidung, den genauen Zeitpunkt zu bestimmen. Potentielle Indikationen beinhalten:
- Dauerhaft steigendes FiO2
- Erhöhte Atemarbeit und Atemnot
- Erhöhter absoluter Sauerstoffbedarf

Intubation

- Dies ist eine Hochrisiko-Prozedur mit der Möglichkeit der Ansteckung durch Personal.
- Vorkehrungen zur Prävention einer Übertragung durch die Luft sind indiziert. (z.B. FFP2/3-Masken oder positive Luft-reinigende Respiratoren, zusätzlich mit vollem Gesichtsschutz und sämtlichen Kontakt-Vorsichtsmaßnahmen).
- Rapid sequence intubation (RSI) ohne Maskenbeatmung kann dazu beitragen, dass es nicht zu einer Aerolisierung von Partikeln kommt. Allerdings kann man überlegen, während der Apnoephase einen Beatmungsbeutel mit PEEP passiv auf das Patientengesicht zu halten, um positiven Druck im Atemweg zu behalten und De-Rekrutierung zu verhindern.
- Der Gebrauch der Videolaryngoskopie kann helfen, dass der die Prozedur Durchführende sein Gesicht nicht zu nahe an den Patienten bringen muss.
- Wenn möglich sollte vor Beginn der Prozedur ein Virenfilter an den Beatmungsbeutel angeschlossen werden. Dieses kann die Verteilung von Viruspartikeln aus dem Tubus nach Intubation verhindern (oder während der Beatmung mit Beatmungsbeutel falls dieses notwendig wird) (Peng et al. 2/27).
- Die Bestätigung einer endotrachealen Lage mittels Stethoskop kann ein Risiko für den Behandler darstellen, sich anzustecken. Es könnte sicherer sein, den Tubus auf eine vorher berechnete Tiefe nach Patientengröße einzulegen (siehe MDCalc Formel hier).
mehr Information
- Weingart: Some additional airway management thoughts (3/10); Intubation packs and preoxygenation for intubation (3/13 & Video:)
Invasive maschinelle Beatmung
Pathophysiologie: COVID-19 verursacht kein typisches ARDS
- COVID-19 scheint nicht substantiell die Compliance der Lunge zu reduzieren (dieses ist sonst ein wichtiges Zeichen bei ARDS).
- Das vornehmliche Problem könnte eins oder mehrere der folgenden sein:
- (i) Atelektasen (Alveolarer Kollaps).
- (ii) Untergang von Alveolen durch Flüssigkeit.
- Wenn das vornehmliche Problem die Atelektasen sind, dann wäre es relativ einfach zu behandeln. Jede Strategie, die den mitteleren Atemwegsdruck aufrechterhält, kann Atelektasen behandeln. (z.B. APRV oder konventionelle ARDSnet Beatmung mit Strategie eines hohen PEEP).
- Falls der Untergang der Alveoli ein wichtiger Aspekt ist, wäre dieses schwieriger zu behandeln. Bauchlage könnte den Abfluss von Sekret unterstützen. APRV könnte ebenfalls sinnvoll sein, um die Atemwege freizuhalten (schnell ausgeführte Atemzüge können einen exspiratorischen Luftstrom erzeugen, welche zu einer Clearance des Sekrets beitragen kann).
Konventionelle Beatmung nach ARDSnet
- Tidalvolumina sollten sich an lungenprotektiven Vorgaben richten (6 cm3/kg ideales Körpergewicht).
- MDCalc kann verwendet werden, um die richtige Tubustiefe und Tidalvolumina zu berechnen.
- Hohe PEEP-Werte sollten verwendet werden. Eine Tabelle mit ARDSnet “hohem PEEP” wird unten aufgeführt. Dieser Tabelle muss man nicht exakt folgen, aber sie ist eine gute Orientierungshilfe.
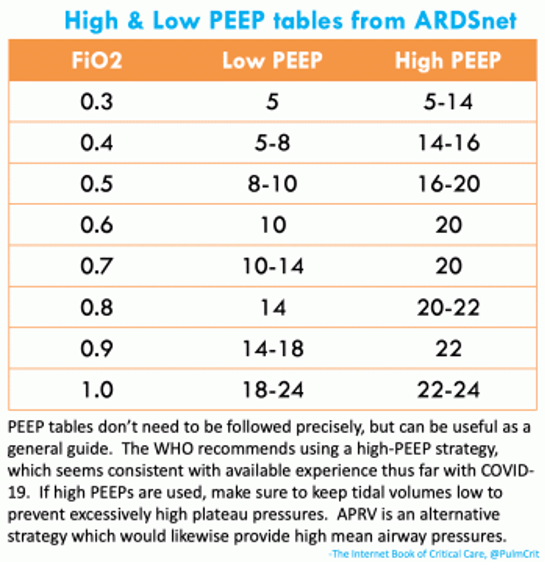
Airway pressure release ventilation (APRV)
- Nach meiner Meinung ist APRV frühzeitig ein sehr nützlicher Beatmungsmodus für diese Patienten (das bedeutet: Verwendung als initialer Beatmungsmodus und nicht als Rückfallebene). APRV kann passend zur Pathophysiologie von COVID-19 sein, da es einen hohen mittleren Atemwegsdruck bereitstellt und die Clearance von Sekret unterstützen kann.
- Eine praktische Anleitung für die Verwendung von APRV ist hier zu finden. Ein vernünftiger Start läge im Allgemeinen bei:
- P-high: 30-35 cm (höher bei deutlicher Hypoxämie)
- P-low: null
- T-high: 5 Sekunden
- T-low: 0.5 Sekunden (titrieren basierend auf der Flowrate; eine Reduktion sollte erwogen werden wenn das Tidalvolumen >8 cm3/kg ist)
- Verbesserung der Oxygenierung unter APRV kann mehrere Stunden dauern wenn Lungengewebe nach und nach rekrutiert wird.
- Der Beginn von APRV kann hämodynamische Veränderungen bewirken, daher sollte der Blutdruck bei Initiierung der Therapie im Blick behalten werden.
- Bei Versagen des APRV innerhalb 12-24 Stunden (z.B. mit PaO2/FiO2 <100-150) spricht dafür, sich zu überlegen, den Patienten in Bauchlage zu drehen (Diskussion hier). Allerdings kann es sein, dass man mit frühzeitig begonnendem APRV eher erfolgreich sein kann – und die Notwendigkeit einer Bauchlage vermeidet.
Permissive Hyperkapnie
- Unabhängig vom Beatmungsmodus kann permissive Hyperkapnie sinnvoll sein. Bis zu welchem Grad permissive Hyperkapnie sicher ist, ist unbekannt. Aber solange die Hämodynamik nicht gestört ist, ist ein pH von >7.1 oder >7.15 tolerabel (Hyperkapnie ist gegenüber Beatmungsformen, die nicht Lungen-protektiv sind, zu bevorzugen).
- Ein häufiger Fehler ist, sich nur auf die Beatmungsparameter zu konzentrieren um den pH während der metabolisch Status / Säure-Basen-Haushalt ignoriert wird.
- ITS-Patienten haben häufig eine non-anion-gap metabolische Azidose (NAGMA). Die Behandlung der NAGMA mit Bikarbonat ist vermutlich am sichersten zur Behandlung des niedrigen pH (statt zunehmende Intensität der Beatmungseinstellung, die die Lungenfunktion bedroht).
- Auch wenn der Säure-Base Status normal ist, kann i.v. Bikarbonat genutzt werden, um den pH zu verbessern, während die lungenprotektive Beatmung fortgesetzt wird (Diskussion hier). Ein leicht erhöhtes Serum-Bikarbonat kann eventuell eine sichere Ventilation mit niedrigen Tidalvolumina unterstützen (Diskussion zu verschiedenen i.v. Bikarbonat-Formen hier)
Bauchlage
- Bevor man über die Bauchlage nachdenkt, sollte die Einstellung der Beatmungsmaschine über 12-24 Stunden optimiert werden (Diskussion hier).
- Wenn keine Verbesserung durch diese Optimierung zu erzielen ist (z.B. bei weiter bestehendem PaO2/FiO2 unter 150 mm), sollte eine Beatmung in Bauchlage in Erwägung gezogen werden.
- Berichte aus Italien beschreiben die Bauchlage als sehr effektiv.
- Dieses ist nachvollziehbar, da die Bauchlage die Rekrutierung der basalen Lungenanteile und Clearance von Sekret verbessert (das scheinen die Hauptprobleme dieser Patienten zu sein).
- Es bleibt die Frage, ob man den gleichen Effekt einfacher durch die Verwendung von APRV erzeugen kann. Patienten in Bauchlage zu bringen ist sehr arbeitsintensiv und verbraucht viel persönliche Schutzausrüstung (da mehrere Behandler den Patienten wiederholt mobilisieren müssen). Wenn der gleiche Effekt durch APRV erzeugt werden kann, wäre dieses die einfachere Lösung (vor allem in Kliniken, die wenig Erfahrung mit der Bauchlage haben).
weitere Informationen
- Mechanical ventilation and coronavirus pneumonia (Giuseppe Natalini, ventilab blog, Google translation aus dem Italienischen)
Beatmungsstrategien im Katastrophenfall
(hier verweisen wir auf das Original-Emcrit-Kapitel, das häufig aktualisiert wird und zum aktuellen Stand nicht auf Verhältnisse im deutschsprachigen Europa anwendbar ist). Link zum Original-Kapitel
Extubation
Potentielle Fallstricke
- Patienten mit COVID-19 reagieren häufig gut auf Intubation und Überdruckbeatmung (a.e. durch Recruitment von Lungenarealen). Leider kann sich dieses Recruitment wieder nach Extubation wieder verringern. Patienten können daher nach Extubation wieder rasch verschlechtern
- Nach einem Webinar mit ialienischen Intensivmedizinern „Vertraue nicht der ersten Verbesserung“, da sich die Patienten früh verschlechtern können
- Allerdings: Auch prolongierte Intubation birgt Risiken!
- Könnten Entzündungszeichen vorhersehen welche Patienten sich verschlechtern? (Z.B. wenn sich ein Patient klinisch bessert, aber CRP, LDH und Lymphopenie alle schlechter werden – vielleicht kann dies eine Verschlechterung vorhersehen und sollte eine geplante Extubation etwas verzögern?
Post-Extubation Unterstützung
- ANZICS Leitlinie gibt an, dass HFNC und/oder NIV (mit einer gut dicht sitzenden Maske und separaten In- und Exspirationsschläuchen) könnte nach Extubation unterstützen, allerdings muss streng auf entsprechende Schutzkleidung des Personals geachtet werden.
- CPAP / NIV mit hohem PEEP kann eventuell „De-Recruitment“ verhindern (mehr zu COVID-19 und CPAP hier).
- Zum Zeitpunkt der Extubation sind Patienten meist über eine Woche krank. Es ist wahrscheinlich, dass die Viruslast zu diesem Zeitpunkt rückläufig ist, so dass das Risiko der Virenübertragung vermindert sein könnte. Mehr zur Übertragung weiter oben.
Gastrointestinal
Transaminasen-Erhöhung
- COVID kann eine milde Erhöhung der Transaminasen (um 200). Fulminante Hepatitis oder Leberversagen ist bisher nicht berichtet worden (B&W Leitlinie)
- Potentielle Mechanismen von Leberschädigung inkludieren (B&W Leitlinie)
- Direkte virale Infektion
- Hepatotoxische Medikation
- Schockleber
- Zytokinsturm / hemophagotische Lymphohistiose (dies wird am ehesten mit Bilirubin-Erhöhung assoziiert)
- Viele Medikamente, die diese Patienten erhalten, können auch Transaminasen erhöhen – daher sollte in jedem Fall die Medikation evaluiert werden.
Nierenversagen
Epidemiologie & Zeitpunkt des Auftretens
- Nierenversagen mit Notwendigkeit einer Nierenersatztherapie ist in einer Subgruppe von Patienten notwendig, die auf die ITS aufgenommen werden. (wahrscheinlich ~5%).
- Ist eher ein spätes Ereignis, das 1-2 Wochen nach Aufnahme auftritt.
Pathogenese
- Akute tubuläre Nekrose a.e. bei generellem Multiorganversagen ist vermutlich der prädominante Faktor.
- Die Ablagerung von Komplement in den Tubuli wurde bei einer Autopsie-Studie bei sechs Patienten beobachtet, dies könnte ein weiterer Faktor sein. (Diao B et al.)
- Der Virus kann an proximale tubuläre Epithel-Zellen binden (die den ACE2-Rezeptor exprimieren), eine direkte Virusinfektion ist also möglich.
Die Behandlung ist supportiv
- Vermeidung von Nephrotoxinen.
- Anpassung von Medikamenten an renale Clearance.
- Hämodialyse-Indikation ist wie bei anderen Patienten zu stellen.
- Die Prognose der Patienten, die Dialyse benötigen ist schlecht. (z.B. Mortalität 10/10 Patienten in einer COVID-19-Studie von Zhou et al).
- Behandlungsziele sollten vor Beginn einer Hämodialyse festgelegt werden.
- Übermäßige Volumengabe sollte vermieden werden um Dialyse zur Volumenreduktion zu vermeiden.
- COVID-19 Patienten könnten hyper-koaguabel sein, es könnte daher Heparin oder Citrat als Antikoagulation für eine CRRT Dialyse nötig sein.
Weiterführende Informationen
- Neph JC ist eine extrem gute Quelle
- AKI edition (Steve Coca, Swapnil Hiremath, Jay Koyner et al.)
- Dialysis edition (Swapnil Hiremath und Joel Topf)
- ACE2 and hypertension edition (Matthew Sparks und Swapnil Hiremath)
Initiale empirische Antibiose
- Zu Beginn kann es Bedenken geben, dass es zu einer superinfizierten bakteriellen Pneumonie gekommen ist. Im Zweifel ist es vernünftig, Blutkulturen und Procalcitonin zu bestimmen bevor man mit einer Antibiotikatherapie beginnt. Je nach diesen Ergebnissen kann nach < 48 h bei fehlendem Hinweis auf eine bakterielle Infektion die Antibiotikatherapie beendet werden (analog zum Management bei Influenza-Peumonie).
- Azithromycin kann potentiell vorteilhafte antivirale Eigenschaften und/oder immunmodulatorische Eigenschaften haben.
- MRSA-Abdeckung?
- COVID scheint das Risiko für MRSA nicht zu erhöhen (anders als Influenza). Das basiert auf Einzelfällen, mit extrem geringem Evidenzlevel.
- MRSA-Therapie sollte nach typischen Indikationen für Patienten mit community-acquired-Pneumonie (CAP) durchgeführt werden (weitere Diskussion hier und hier).
- Exzessive Nutzung von Vancomycin sollte vermieden werden, da Patienten ein erhöhtes Risiko für Nierenversagen haben.
- Algorithmus für Patienten, die potentiell MRSA-Behandlung bei CAP benötigen.
Verzögerte bakterielle Superinfektion
- Eine bakterielle Pneumonie kann sich während des Klinikaufenthalts entwickeln (insbesondere Ventilator-assoziierte Pneumonie bei intubierten
Patienten).- Bei Patienten, die an COVID-19 gestorben sind, hatten bei einer Fallserie
11/68 (16%) sekundäre Infektionen (Ruan3/3/20).
- Bei Patienten, die an COVID-19 gestorben sind, hatten bei einer Fallserie
- Ein ähnliches Vorgehen wie bei anderen Ventilator-assoziierten Pneumonien oder im Krankenhaus erworbenen Pneumonien sowohl bei Diagnostik als auch Behandlung ist möglich.
Disseminierte intravasale Koagulation (DIC)
Diagnose / Labor
- Gerinnungslabor bei Aufnahme meist relativ normal, wobei häufig erhöhtes D-Dimer auftritt
- Disseminierte intravasale Koagulation (DIC) kann sich im Verlauf entwickeln und wird mit schlechter Prognose vergesellschaftet (Tang et al. 2020)
- Thrombelastographie (TEG/ROTEM) könnte theoretisch hilfreich sein um die Gerinnungssituation bei DIC einzuschätzen (keine spezifischen Daten für COVID-19 verfügbar).
- Bedside Sonographie (POCUS) zur Evaluation von Beinvenenthrombosen kann erwogen werden, besonders bei klinischen Anzeichen für TVT.
Klinische Relevanz
- Verschlechterung der DIC ist ein genereller Marker für schlechte Prognose
- DIC kann ein Zeichen der hemophagozytischen Lymphohistiocytose (HLH) sein. Kombiniert mit anderen klinischen Symptomen kann dies eine Indikation für immunmodulatorische Therapie sein (z.B. Tocilizumab).
- Generell scheint DIC bei COVID mehr Probleme mit Thrombenbildung (Clotting) statt mit Blutung zu sein (z.B. erhöhtes berichtetes Risiko von TVT/LE und pulmonale Mikrothrombose)
- Fibrinogen kann deutlich erhöht sein, trotz Fibrinolyse und erhöhten Fibrinspaltungsprodukten (z.B. D-Dimer) (Han et al 2020). Konsistent erhöhte Fibrinogen-Spiegel könnten anzeigen, dass Fibrinogen ein Akute-Phase Marker ist, dessen Synthese durch pro-inflammatorische Zytokine stimuliert wird (speziell IL-6) (Carty 2010). Erhöhte Fibrinogen-Spiegel können generell eine pro-Koagulatorische Tendenz verstärken.
Management
- Wenn Patient generell den Verdacht auf hämophagozytotische Lymphohistiocytose bietet, können Tocilizumab oder andere Immunmodulatoren erwogen werden.
- Für Patienten ohne klinische Blutungszeichen:
- TVT-Prophylaxe sollte generell beibehalten werden, außer die Thrombozyten sind unter 25 (ISTH Leitlinie 3/25)
- Therapeutische Antikoagulation mit Heparin ist empfohlen worden bei Patienten mit D-Dimer über 2000 ng/ml, dies ist aber nicht nachgewiesen (Lin et al, Tang et al 3/27).
- Bei extrem niedrigen Fibrinogen-Spiegeln (>100 mg/dl) sollte Fibrinogen-Gabe zur Verminderung des Blutungsrisikos erwogen werden
- Thrombozyten-Transfusion sollte nach üblichen Standards durchgeführt werden (z.B. <10.000 Thrombozyten).
- Für Patienten mit klinischen Blutungszeichen: Blutprodukte nach Schwere und Lokalisation der Blutung
- Für Patienten mit Thrombose (TVT/LE): Antikoagulation ist indiziert.
Purpura fulminans
- Extreme, pro-thrombotische Form der DIC, die ausgedehnte subkutane Pupura erzeugt, die bis zur ischämischen Nekrose von Fingern und Zehen führen kann
- Dies kann bei COVID-19 auftreten. Die Diagnose ist klinisch, basierend auf dem typischen Aussehen der Extremitäten und laborchemischen Auffälligkeiten (z.B. deutlich erhöhtes D-Dimer).
- Die Behandlung der Purpura Fulminans ist herausfordernd:
- Antikoagulation mit Heparin wird generell empfohlen. Allerdings ist ein Antithrombin-3-Mangel häufig, daher sind die Patienten oft Heparin-resistent. Um eine therapeutische Wirkung zu erreichen, können sehr hohe Heparin-Dosen nötig sein, oder sogar Supplementation von Antithrombin.
- Topisches Nitroglycerin oder möglicherweise intravenöses Epoprostanol könnte genutzt werden, um kutane Vasodilatation zu erwirken und dem Verlust von Fingern/Zehen zu vermeiden.
- Mehr zur Purpura Fulminans hier.
Weiterführende Information
Kommentare und Diskussion auf der Emcrit-Seite zu COVID-DIC.
Glykämische Kontrolle und Diabetes
- Hintergrund:
- Der ACE-2 Rezeptor ist auch auf den Langerhans-Inselzellen des Pankreas zu finden, dies erhöht die Wahrscheinlichkeit, dass der Virus direkt den Pankreas beeinträchtigen kann (Yang et al. 2010).
- Es ist gezeigt worden, dass SARS eine intermittierende Insulinresistenz erzeugen kann.
- Aktuell gibt es zu COVID-19 keine Evidenz.
- Mögliche Vorhersagen zu COVID-19 (aktuell sind das reine Schätzungen!)
- Patienten mit Typ-I Diabetes und COVID-19 könnten mit diabetischer Ketoazidose vorstellig werden (statt typischer pulmonaler Symptomatik)
- Patienten ohne Diabetes können auf der Intensivstation hyperglykäm werden, die Behandlung könnte aggressiver nötig sein, als bei normalen Patienten.
ECMO
- Patienten mit COVID-19 können auch jung sein und ein Ein-Organ-Versagen, welches reversibel ist, erleiden. Daher wären diese gute Kandidaten für eine ECMO.
- VV-ECMO sollte für respiratorisches Versagen verwendet werden (obwohl es unklar ist, wie häufig echte refraktäre Hypoxämie auftritt).
- VA-ECMO sollte bei Patienten mit fulminanter Kardiomyopathie und kardiogenem Schock angewendet werden
- Genaue Indikationen und genauer Zeitpunkt bleiben unklar.
- In einer Epidemie sind ECMO-Kapazitäten wahrscheinlich schnell erschöpft. Sehr schwierige ethische Fragen können dabei entstehen (z.B. wie lang darf ein Patient an einer ECMO verbleiben bevor man die Therapie beendet, um einem anderen Patienten diese Therapie nicht vorzuenthalten).
Weiterführende Informationen
- Infographics on ECMOed von M Velia Antonini
Individuelle prognostische Faktoren
Überblick: drei generelle Bereiche
- Epidemiologische Risikofaktoren
- Alter > ~55-60 J.
- COPD
- Chronische Niereninsuffizienz
- Diabetes
- Hypertension
- Koronare Herzerkrankung
- Transplant oder andere Form einer Immunsuppression
- HIV
- Vitalparameter
- Atemfrequenz >24 /min.
- Herzfrequenz > 125/min.
- Sauerstoffsättigung <90% RL
- Labor
- D-Dimer > 1000 ng/ml
- Ferritin >300 ug/L
- LDH >245 IU/L
- Absolute Lymphozytenzahl < 0.8
- CRP >100
mehr zu Labor-Abnormalitäten
- Blutbild-Abnormalitäten
- Lymphopenie und seine Trends (verlängert oder sich verschlechternde Lymphopenie spricht für ein schlechtes Outcome)(Chu et al. 2004)
- Neutrophile-/Lymphozyten-Verhältnis ratio (NLR) scheint ein überlegender prognostischer Marker zu sein im Vergleich zu Lymphopenie oder CRP (Liu et al. pre-print). Wie im 2. Bild weiter unten gezeigt, ist eine NLR >3 hinweisgebend auf eine schlechte Prognose.
- Andere Prädiktoren eines schlechten Outcomes können Entzündungsparameter sein (CRP und Ferritin), LDH und D-Dimer. D-Dimer-Erhöhung über 1 ug/L war der stärkste unabhängige Mortalitätsprädiktor bei Zhou et al. 3/9/20.
- Troponin ist ein prognostischer Faktor, aber es könnte herausfordernd sein, die verschiedenen Werte, die in verschiedenen Laboratorien erhoben worden sind, zu vergleichen.
- (References: Ruan 3/3/20, Xie et al. 2020, Wang et al. 2/7/20., Zhou et al. 3/9/20)
- Bild von D-Dimer, Ferritin, LDH, und Lymphozyten-Trends bei Überlebenden & nicht-Überlebenden hier.
- Bild von CRP, Troponin und IL-6 bei Überlebenden vs. nicht-Überlebenden hier.
- Bild von BB, Lymphozyten und D-Dimer bei Überlebenden vs. nicht-Überlebenden hier.
Generelle Prognose
- (1) Es bleibt unklar, welcher Teil der Patienten ins Krankenhaus aufgenommen werden.
- Es gibt viele Patienten mit mildem Verlauf, die sich nicht medizinisch vorstellen und die nicht gezählt werden.
- Der größte Teil infizierter Patienten (ca. > 80%) werden nicht schwer krank und benötigen daher keine Hospitalisierung.
- (2) Bezogen auf hospitalisierte Patienten (Guan et al 2/28)
- ~10-20% der Patienten werden auf die Intensivstation aufgenommen.
- ~3-10% benötigen eine Intubation.
- ~2-5% sterben.
- (3) Outcome auf längere Sicht: Verlängerte Abhängigkeit von einem Beatmungsgerät?
- Patienten, die die Initialphase der Erkrankung überstehen, können dennoch für eine längere Zeit eine Beatmung benötigen (möglicherweise entwickeln sie radiologische Zeichen einer Fibrose) (Zhang 2020).
- Wenn die Epidemie fortschreitet, kann es zu Schwierigkeiten kommen, da man viele Patienten nicht von einer maschinellen Beatmung entwöhnen kann.
- (Hinweis: Es sind viele verschiedene Daten veröffentlicht, die sich sehr unterscheiden. Allerdings sind die exakten Zahlen vom klinischen Standpunkt aus unerheblich.)
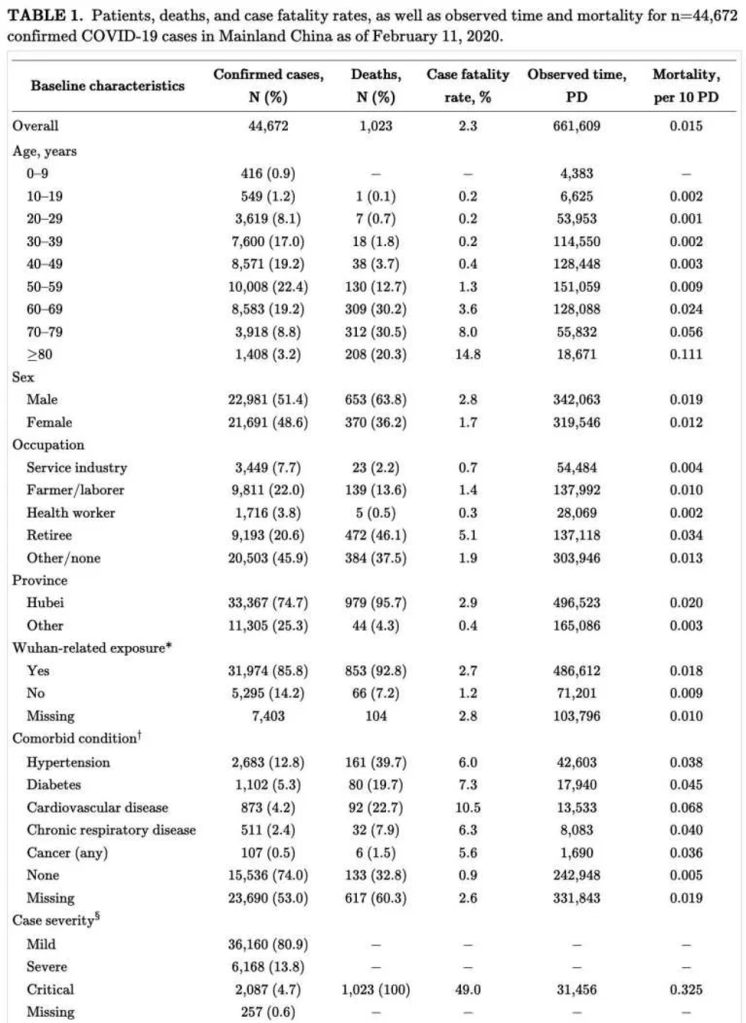
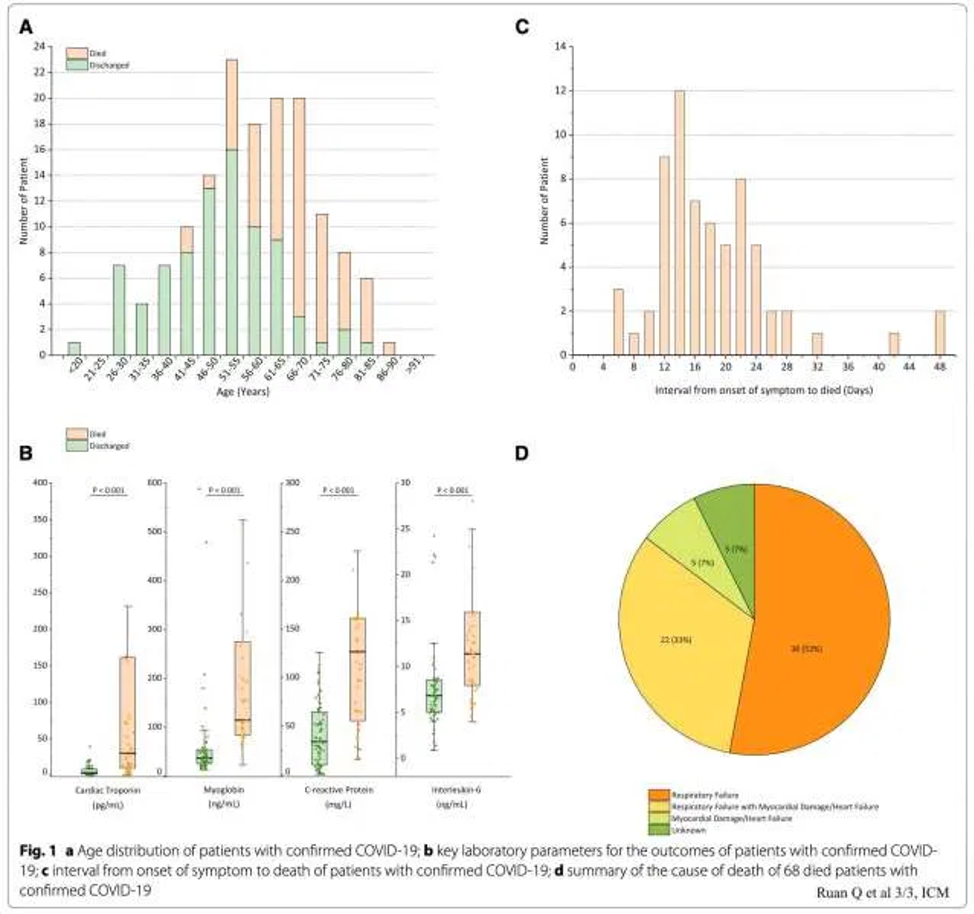
Disposition
Vermeidung von unnötigen Besuchen in Notaufnahme oder Klinik
- Innerhalb des Gesundheitssysstems sollten idealerweise die Patienten von Klinik und Notaufnahme ferngehalten werden, die nur zur Testung für COVID-19 kommen (z.B. wenn sie milde Allgemeinsymptome haben und sonst keine weitere medizinische Betreuung benötigen).
- Viele System haben ein System eines “Drive-In” zur Durchführung von Tests entwickelt. Dadurch kommen keine anderen Patienten in der Notaufnahme mit diesen in Kontakt. Das Testen draußen durchzuführen ist aufgrund der zirkulierenden Frischluft ebenfalls vorteilhaft.

Ambulante Behandlung / häusliche Quarantäne
- Der größte Teil an Patienten mit COVID-19 wird ohne Notwendigkeit medizinischer Supervision gesund werden (vielleicht >80% der Patienten).
- Patienten mit milden Symptomen können in der Regel mit dem Hinweis sich zu isolieren nach Hause entlassen werden. Diese Entscheidung sollte in Koordination mit dem örtlichen Gesundheitsamt getroffen werden, welches das Follow-up machen kann.
- Faktoren, die einen Verbleib zu Hause unterstützen:
- Verständnis und Mitarbeit bei Selbst-Isolation (z.B. eigenes Schlaf- und Badezimmer).
- Fähigkeit und Möglichkeit Hilfe zu holen bei Verschlechterung.
- Wenn im selben Haushalt keine Patienten mit Risikofaktoren für eine potentielle COVID-19-Erkrankung wohnen (z.B. Ältere, Schwangere oder Menschen mit signifikanten Komorbiditäten).
- Fehlen einer Hypoxämie, nachweisbaren Lungeninfiltraten oder anderen Faktoren, die für eine stationäre Aufnahme sprechen.
- Für weitere Informationen, siehe CDC interim guidance für die Entscheidungsfindung über den Verbleib von Patienten mit COVID-19 hier und hier. (Kommentar: Siehe auch RKI-Empfehlungen zur ambulanten Behandlung)
Weitere Quellen:
- Journals & Fachgesellschaften zum Thema COVID-19
- Leitlinien
- ANZICS guidelines
- Belgium guidelines
- University of Pennsylvania treatment guidelines
- Surviving Sepsis Campaign Guidelines
- Brigham & Women’s Guidelines
- Deutschsprachige (von Übersetzung eingefügt)
- Intensivmedizin bei COVID
- Palliativmedizin bei COVID
- Triageentscheidung / Ethik (DIVI, DGINA et al)
- FOAMed zu COVID-19
- Paul Marik’s treatment approach to COVID-19
- WHO guidelines on fluid administration for COVID-19 are dangerous (PulmCrit)
- EMCrit RACC on airway management in COVID-19 (Weingart & Brian Wright)
- COVID-19 on RebelEM (Salim Rezaie)
- COVID-19 on St. Emlyns (Ashley Liebig)
- COVID-19 on Radiopaedia (Daniel Bell)
Disclaimer:
Der hier gezeigte Text ist eine genehmigte Übersetzung eines Originalartikels, für die Inhalte übernehmen wir keine Haftung und bitten insbesondere vor Einleitung einer Therapie immer das Prüfen auf Plausibilität und Quellen. Wir bemühen uns um regelmäßige Aktualisierung, wenn das neben der klinischen Arbeit möglich ist (Stand: 31.03.2020).
Wir bedanken nochmals uns sehr herzlich bei Steffen Grautoff für die Bereitstellung der ersten Übersetzung und bei Josh Farkas für seine geniale Arbeit rund um die Aufklärung bzgl. COVID-19


Informativer Text, mag‘ ich sehr. 🙂
Lg aus der Schweiz
-M. S.
Informativer Artikel, mag‘ ich sehr. 🙂
Lg aus der Schweiz
-M. S.
Danke für deine Erklärung. Ich finde das sehr Interessant und bin auch froh, dass ich fast alles verstanden hab. In der heutigen Zeit ist Aufklärung nicht so gegeben.
LG
Miss Katherine White
http://WWW.miss-katherine-White.com
work – life – balance
Hallo liebe Leute, danke für den tollen Beitrag, aber nur eine Bitte: verwechselt nicht Covid-19 mit Sars-Cov2. Das ist so wie HIV mit AIDS zu verwechseln. Covid-19 ist die Krankheit (das d steht für disease) und Sars-Cov2 das auslösende Virus.
LG, Petra
Danke für die Ergänzung, das geht oft in der Verkürzung unter.
Konkret geht es uns in der Therapie (vor allem in der Intensivmedizin) primär um COVID-19.
Die Unterscheidung ist wichtig, im Text wird darauf hingewiesen, warum ausschließlich von COVID-19 gesprochen wird. Siehe folgenden Auszug:
Nomenklatur, die in diesem Kapitel verwendet wird
Korrekterweise sollte das Virus “SARS-CoV-2” benannt werden und die klinische Erkrankung heißt “COVID-19.” Das ist verwirrend, daher wird in diesem Kapitel “COVID-19” für beide Entitäten verwendet.
Der Begriff “SARS” wird für das ursprüngliche SARS-Virus aus dem Jahr 2003 verwendet (welches mittlerweile in SARS-CoV-1 umbenannt wurde)
Vielen, Vielen Dank für diese exzellente Auflistung, die wirklich praktisch relevant ist. DANKE